
题目列表(包括答案和解析)
2.(2009·汕头)某地发生了食用熟牛肉中毒事件,导致四个死亡、一百多人中毒。经过对该牛肉的检测,发现其中某盐的含量比国家标准允许的含量高800多倍,则该盐可能是( )
A.NaNO2 B.NaNO3
C.NaCl D.BaSO4
解析:亚硝酸盐是工业用盐,它在外观上类似食盐,误食会引起中毒,国家标准中,肉制品的亚硝酸盐含量是被限制使用的;由题意知,该盐为NaNO2,A项正确;NaNO3、NaCl、BaSO4食用后,不会引起中毒现象,B、C、D项不正确。
答案:A
1.(2009·皖南八校)为迎接北京奥运,北京曾采用机动车按照单双号行驶的方案,该方案既保障了交通秩序,又大大减少了空气污染。汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
A.氮气 B.硫化氢
C.二氧化硫 D.氮的氧化物
解析:汽车的尾气中,除了含有碳氢化合物、可吸入颗粒物、一氧化碳外,还含有氮的氧化物,汽车尾气最主要的危害是形成光化学烟雾。
答案:D
14.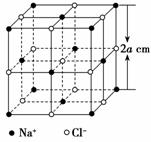 (14分)某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
(14分)某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
a.将固体NaCl研细并干燥,准确称取m g NaCl晶体装入定容仪器A中。
b.用仪器B向A中滴加苯,不断振荡,继续加苯至刻度线
c.重复上述步骤2~3次,计算出m g NaCl的体积平均为V cm3。
(1)步骤a中A仪器最好使用 (填序号)。
A.量筒 B.烧杯
C.容量瓶 D.试管
(2)步骤b中仪器B为 (填“酸式”或“碱式”)滴定管,因为 。
(3)该实验不能用水代替苯,原因是 。
(4)该方法测出的阿伏加德罗常数的表达式为 。
(5)某同学乙受甲的启发,欲用同样的方法使用固体碘来测定,能否成功? 。
13.(12分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.050 0 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
12.(10分)(1)若某药品质量约为32.0 g,用托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下。
|
50 g |
20 g |
20 g |
10 g |
5 g |
|
|
|
|
|
|
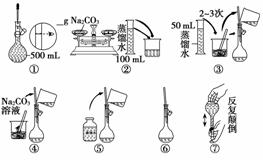 (2)配制500 mL 0.1 mol·L-1 Na2CO3溶液,下图操作②中应该填写的数据为 ,实验时下图所示操作的先后顺序为 (填编号)。
(2)配制500 mL 0.1 mol·L-1 Na2CO3溶液,下图操作②中应该填写的数据为 ,实验时下图所示操作的先后顺序为 (填编号)。
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒量取液态溶质,读数时,俯视量筒,所配制溶液的浓度 。
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度 。
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度 。
11.(14分)(1)实验室里需用480 mL 0.1 mol/L的CuSO4溶液,①以下配制方法正确的是 。
A.称取7.68 g CuSO4加入500 mL水
B.称取12.0 g胆矾加入500 mL水
C.称取8.0 g CuSO4加入500 mL水
D.称取12.5 g胆矾配成500 mL溶液
②假如其他操作均准确无误,分析下列情况对配制浓度的影响
A.定容时俯视观察刻度线: ;
B.移液时,对用于溶解CuSO4(或胆矾)的烧杯没有洗涤: ;
C.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,又补加水至刻度线: 。
(2)用98%(密度为1.84 g/cm3)的浓硫酸稀释成3 mol/L的稀硫酸100 mL,回答下列问题:
①需要浓硫酸 mL;
②配制操作可分解成如下几步,正确的操作顺序是 。
A.向容量瓶中注入少量水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.将已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹液面恰好与刻度线相切
H.缓缓地将蒸馏水注入容量瓶内,直到容量瓶中的液面接近容量瓶刻度1 cm~2 cm处
10.(2009年浙江绍兴一中高三期末)20℃时,饱和KCl溶液的密度为1.174 g·cm-3,物质的量浓度为4.0 mol·L-1,则下列说法中正确的是 ( )
A.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为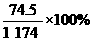
C.20℃时,密度小于1.174 g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3
9.已知(1)某饱和溶液的体积;(2)密度;(3)溶质和溶剂的质量比;(4)溶质的摩尔质量。要根据溶质的溶解度计算其饱和溶液的物质的量浓度时,在上述条件中,必不可少的是 ( )
A.(1)(2)(3)(4) B.(1)(4)
C.(2)(4) D.(1)(2)(4)
8.有A、B两种硫酸溶液,A溶液硫酸的质量分数为5a %,B溶液硫酸的质量分数为a %,将A、B两溶液等体积混合后,所得硫酸溶液中硫酸的质量分数是 ( )
A.小于3a % B.等于3a %
C.大于3a % D.无法确定
7.有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)(mol/L)为 ( )
A.(y-2x)/a B.(y-x)/a
C.(2y-2x)/a D.(2y-4x)/a
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com