
题目列表(包括答案和解析)
20.(1)在温度T下,某溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,该温度下水的离子积KW=__________;T__________(填“大于”“小于”或“等于”)25℃。
(2)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
|
序号 |
氢氧化钡的体积/mL |
盐酸的体积/mL |
溶液的pH |
|
① |
22.00 |
0.00 |
12 |
|
② |
22.00 |
18.00 |
11 |
|
③ |
22.00 |
22.00 |
7 |
x=__________,Ba(OH)2溶液的物质的量浓度为__________。
(3)常温下,向100 mL pH=2的硫酸与硫酸钠的混合溶液中,加入300 mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH__________(填“大于”“小于”或“等于”)7;原混合溶液中硫酸钠的物质的量浓度为__________________。
解析:(1)KW=c(H+)·c(OH-)=10-a×10-b=10-(a+b) =10-12>10-14,温度高于常温。
(2)根据数据①,c[Ba(OH)2]=10-2×mol·L-1=5×10-3 mol·L-1,根据数据③,盐酸c(H+)等于Ba(OH)2中c(OH-),为10-2mol·L-1,pH=2。
(3)混合溶液中加入Ba(OH)2,Ba(OH)2过量,溶液呈碱性。当沉淀正好达到最大量时,n(SO)=n(Ba2+),n(Na2SO4)=n[Ba(OH)2]-n(H2SO4)=5×10-3×0.3-0.01××0.1=0.001 mol,浓度为0.01 mol·L-1。答案:(1)1×10-12 大于 (2)2 5×10-3mol·L-1
(3)大于 0.01 mol·L-1
19.某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视__________________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并__________________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是__________。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束后俯视读数
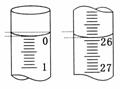
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为__________mL,终点读数为__________mL;所用盐酸溶液的体积为__________mL。
解析:(1)滴定实验中规范操作为“左控塞,右摇瓶,眼睛注视锥形瓶内溶液颜色的变化”。
(2)误差分析应根据c(NaOH)=分析。酸式滴定管未用标准盐酸润洗,内壁附着水,可将加入的盐酸冲稀,消耗相同量的碱,所需盐酸的体积偏大,结果偏高;用碱式滴定管取出的待测NaOH的物质的量一旦确定,倒入锥形瓶后,加水不影响OH-的物质的量,也就不影响滴定结果;若排出气泡,液面下降,故读取的V酸偏大,结果偏高;正确读数和错误读数(实线部分)如图示:

(3)读数时,以凹液面的最低点为基准。
答案:(1)锥形瓶内溶液颜色的变化 半分钟内不褪色 (2)D (3)0.00 25.90 25.90
18.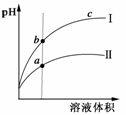 (2009·山东)某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。 ( )
(2009·山东)某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如右图所示。 ( )
A.Ⅱ为盐酸稀释时的pH变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
解析:pH相同的盐酸和醋酸加水稀释时,盐酸的变化大于醋酸(醋酸可电离补充H+),因温度几乎无变化,KW不变。
答案:B
17.(2009·重庆)物质的量浓度相同的下列溶液,pH由大到小排列正确的是 ( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4 、H2 SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
解析:pH由大到小排列次序为碱→强碱弱酸盐(同类看对应酸的强弱)→中性盐→强酸弱碱盐→酸(看强弱)。
答案:B
16.通过对下图的观察,判断以下几种叙述中不正确的是 ( )
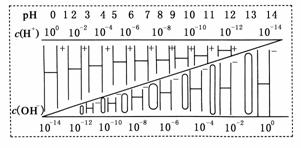
A.该温度下,不论何种水溶液中c(H+)、c(OH-)的乘积相等,即水的离子积是一个常数
B.若醋酸钠溶液中c(Na+)=c(CH3COO-),则溶液中的c(H+)=c(OH-)
C.如果定义pOH=-lg c(OH-),则该温度下某水溶液中的pOH和pH之和等于14
D.某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
解析:该温度下,c(H+)·c(OH-)=1×10-14,A项正确;醋酸钠溶液中c(Na+)=c(CH3COO-)时,根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(H+)=c(OH-),B项正确:pOH+pH=-lgc(OH-)-lgc(H+)=-lg[c(H+)·c(OH-)]=14,C项正确;如果水溶液温度降低,水的电离程度减小,水的离子积减小,当氢离子浓度变小,氢氧根离子浓度也可能减小,D项错误。
答案:D
15.(2009·河南)常温时,以下4种溶液pH最小的是 ( )
A.0.01 mol·L-1醋酸溶液
B.0.02 mol·L-1醋酸与0.02 mol·L-1 NaOH溶液等体积混合液
C.0.02 mol·L-1醋酸与0.01 mol·L-1 NaOH溶液等体积混合液
D.pH=2的盐酸与pH=12的NaOH溶液等体积混合液
解析:B项中醋酸和氢氧化钠等物质的量等体积混合后,生成CH3COONa和H2O,溶液呈碱性,pH最大;C项经反应后,醋酸剩余,余下醋酸的浓度为0.01 mol·L-1,CH3COONa电离产生的CH3COO-抑制醋酸的电离,使pH大于A项中的pH;D项pH=2的盐酸与pH=12的氢氧化钠溶液等体积混合,溶液呈中性,其pH等于7,综上所述,只有A项正确。
答案:A
14.(2009·黄冈)已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是 ( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
B.水电离出来的c(H+)=1×10-10mol·L-1
C.c(H+)=c(OH-)+c (SO)
D.该温度高于25℃
解析:某温度下,pH=6的蒸馏水中KW=1×10-12,加NaHSO4晶体测得溶液的pH为2,其中c(H+)=1×10-2mol·L-1,pH=12的NaOH溶液中c(OH-)=1mol·L-1,二者反应后的溶液呈碱性。
答案:A
13.(2009·东北师大附中高三模拟)甲、乙两杯醋酸稀溶液,甲的pH=a ,乙的pH=a+1,对下列叙述的判断正确的是 ( )
①甲由水电离出来的H+的物质的量浓度是乙的倍
②物质的量浓度c(甲)=10c(乙)
③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
④甲中的c(OH-)为乙中的c(OH-)的10倍
A.①②④正确 B.①③正确
C.②④正确 D.只有①正确
解析:甲溶液的pH=a,由水是离出来的c(OH-)水=c(H+)水=1×10a-14mol·L-1;乙溶液的pH=a+1,由水电离出来的c(OH-)水=c(H+)水=1×10a+1-14mol·L-1=1×10a-13mol·L-1,故只有D项正确。
答案:D
12.(2009·华中师大附中高三期中)下列各溶液中能大量共存的离子组是 ( )
A.使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO、K+
B.使pH=1的溶液中: Fe2+、I-、NO、Cl-
C.c(H+)=1.0×10-14mol·L-1的溶液中:Na+、AlO、S2-、SO
D.水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HCO、Ca2+
答案:C
11.室温下,甲溶液中水电离出的H+浓度为10-12mol·L-1,乙溶液中水电离出的H+浓度为10-2mol·L-1,下列说法正确的是 ( )
A.甲、乙两溶液的pH不可能相同
B.甲、乙两种溶液中加入Al粉都一定会产生H2
C.HCO不可能在甲、乙两溶液中大量共存
D.甲不可能是盐溶液,乙不可能是酸或碱溶液
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com