
题目列表(包括答案和解析)
20.(1)根据下表所列的数据,可以得出HX、HY、HZ三种一元酸的酸性由强到弱的顺序是__________。
|
酸 |
HX |
HY |
HZ |
|
|
|
浓度(mol·L-1) |
0.1 |
0.5 |
0.9 |
1 |
1 |
|
电离度(α) |
0.3 |
0.15 |
0.1 |
0.3 |
10 |
(2)25℃时,测得浓度为0.1 mol·L-1的HA溶液的pH=3,则HA的电离常数Ka=__________。
(3)苯酚
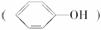 具有弱酸性,其电离常数介于H2CO3的Ka1和Ka2之间。则向苯酚钠
具有弱酸性,其电离常数介于H2CO3的Ka1和Ka2之间。则向苯酚钠 溶液中通入二氧化碳气体,所发生反应的化学方程式是__________。
溶液中通入二氧化碳气体,所发生反应的化学方程式是__________。
(4)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO+H+的平衡常数K1=__________。(已知:10-5.60=2.5×10-6)
解析:(1)当HY和HZ的浓度相等时,α(HZ)>α(HY),则酸性HZ>HY;当HX和HY的电离度均为0.3时,c(HX)<c(HY),说明当c(HX)=c(HY)时,α(HX)<α(HY),即酸性HY>HX。
(2)由HAH++A- 知c(H+)=c(A-)=10-3mol·L-1,
则Ka==1×10-5mol·L-1。
(3)酸性:H2CO3>
 >HCO,则H2CO3能与
>HCO,则H2CO3能与 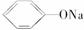 反应但HCO不与
反应但HCO不与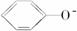 反应,不管CO2是少量还是过量,均只生成NaHCO3。
反应,不管CO2是少量还是过量,均只生成NaHCO3。
(4)根据平衡常数K1=,c(H+)=c(HCO)=2.5×10-6mol·L-1,c(H2CO3)=1.5×10-5mol·L-1,可求出K1。
答案:(1)HZ>HY>HX (2)1×10-5
(3)
 +CO2+H2O―→
+CO2+H2O―→ +NaHCO3 (4)4.2×10-7
+NaHCO3 (4)4.2×10-7
19.为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确?__________(填“是”或“否”)并说明理由__________________。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测出其pH=a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认NH3·H2O是弱电解质,则a、b值应满足什么关系?__________(用“等式”或“不等式”表示)。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入NH4Cl晶体少量,颜色变__________________(填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质?并说明原因:__________________。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质:________________________________。
答案:(1)是 若是弱电解质,则0.010 mol·L-1氨水溶液中c(OH-)应为0.010 mol·L-1,pH=12
(2)a-2<b<a
(3)浅 不能,因为0.010 mol·L-1氨水(滴有酚酞)中加入氯化铵晶体后颜色变浅,有两种可能:一是氯化铵在水溶液中水解显酸性,加入氨水中使溶液的pH降低;二是NH使NH3·H2O 的电离平衡NH3·H2ONH+OH-逆向移动,从而使溶液的pH降低。这种方法证明NH3·H2O是弱电解质不严密
(4)取一张pH试纸,再用玻璃棒蘸取0.1 mol·L-1 NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可)
18.现有下列物质:①酒精,②氯化铵,③氢氧化钡,④氨水,⑤磷酸,⑥碳酸氢钠,⑦硫酸,⑧硫酸钡,⑨二氧化碳,⑩氯气,⑪石墨,⑫熔融的氧化铝,⑬氢氧化铜。用序号填写下列空白。
(1)属于电解质的是__________;
(2)属于非电解质的是__________;
(3)属于强电解质的是__________;
(4)属于弱电解质的是__________;
(5)能导电的是__________;
(6)在电解质中属于离子化合物的是__________;
(7)属于共价化合物的是__________。
答案:(1)②③⑤⑥⑦⑧⑫⑬ (2)①⑨ (3)②③⑥⑦⑧⑫ (4)⑤⑬ (5)④⑪⑫ (6)②③⑥⑧⑫⑬ (7)⑤⑦
17.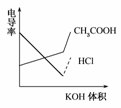 (2008·广东高考题)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 ( )
(2008·广东高考题)电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。如图是用KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是 ( )
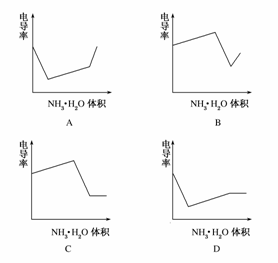
答案:D
16.一元弱酸HA(aq)中存在下列电离平衡:HAH++A-。将1.0 mol HA分子加入水中配成1.0 L溶液,如图表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是 ( )
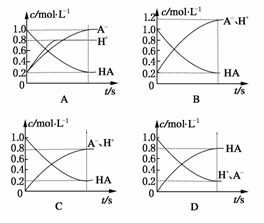
答案:C
15.(2009·皖西四校模拟)下列实验与对应的图像符合的是 ( )

A.向一定量的CH3COOH溶液中通入NH3至过量
B.向等物质的量的HCl和AlCl3溶液中滴入NaOH溶液至过量
C.对于达到平衡状态的N2(g)+3H2(g)2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡
D.将pH=2的盐酸和醋酸分别加水稀释
解析:当向CH3COOH溶液中通入NH3时,将发生反应CH3COOH+NH3===CH3COONH4,CH3COONH4为强电解质,而CH3COOH为弱电解质,反应后溶液中离子浓度升高,溶液导电能力增强,A项错;向等物质的量的HCl和AlCl3溶液中加入NaOH溶液至过量,将依次发生反应:NaOH+HCl===NaCl+H2O,AlCl3+3NaOH===Al(OH)3↓+3NaCl,Al(OH)3+NaOH===NaAlO2+2H2O,其图像与反应事实不符,B项错误;C项当t1时缩小容器体积,则平衡正向移动,v′(正)>v′(逆),C项错误,盐酸为强酸溶液。
答案:D
14.用水稀释0.1 mol/L氨水时,溶液中随水量的增加而减小的是 ( )
A.c(OH-)/c(NH3·H2O)
B.c(NH3·H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积
D.n(OH-)
答案:B
13.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。
由此可判断下列叙述不正确的是 ( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得到一元弱酸的强弱顺序为:HF>HNO2>HCN
D.K(HCN)< K(HNO2)<K(HF)
答案:B
12.(2009·辽宁)将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是 ( )

解析:在CH3COOH未完全中和完以前,c(NaOH)趋于0。
答案:D
11.(2009·广东)下列说法正确的是 ( )
A.向0.1 mol·L-1Na2CO3溶液中滴加酚酞,溶液变红色
B.Al3+、NO、Cl-、CO、Na+可大量共存于pH=2的溶液中
C.乙醇和乙酸都能溶于水,都是电解质
D.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
解析:B中Al3+与CO、CO与H+不能大量共存;C中乙醇属于非电解质,D中H2SO4消耗的NaOH多。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com