
题目列表(包括答案和解析)
10.设X、Y、Z代表三种元素。已知:
①X+和Y-两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两种元素可以形成4核和42个电子的-1价阴离子。
据此,请填空:
(1)Y元素是______________________________,Z元素是___________________________。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是________________。
解析:依题意,假设元素Y的原子序数为y,则元素Z的原子序数为(y-9)。若以(YmZn)-表示由这两种元素所形成的4核42个电子的-1价离子,则下列关系式成立:
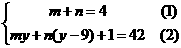
①×y-②得:9n=4y-41,所以y=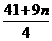 。
。
因为n为整数,将其可能的取值1、2和3分别代入上式,经检验确定:n=3,y=17。所以,元素Y的原子序数为17,它是氯(Cl),而元素Z的原子序数为(17-9)=8,它是氧(O),进而可知元素X为钾(K),这三种元素所形成的含68个电子的盐的化学式为KClO4(所含电子数为:19+17+4×8=68)。
答案:(1)氯 氧 (2)KClO4
9.(2010全国高考理综Ⅲ,29)A、B、C、D、E分别代表5种粒子,每种粒子中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D,E具有强氧化性。请完成下列问题:
(1)用化学符号表示上述5种粒子:
A_____________________________,B_____________________________,
C_____________________________,D_____________________________,
E_____________________________。
(2)在水溶液中A跟B反应的离子方程式是_____________________________。
解析:(1)中学化学中18e-的物质有分子:Ar、F2、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6,阴、阳离子:S2-、Cl-、K+、Ca2+等。从题给信息“A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性”可以确定A是S2-,B是HCl,C是Cl-,D是H2S,F是F2。(2)在水溶液中A跟B反应的离子方程式是:S2-+2H+====H2S↑。
答案:(1)S2- HCl Cl- H2S F2
(2)S2-+2H+====H2S↑
8.对于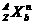 ,按下列要求各举一例(即每小题分别写出符合题意的两种粒子):
,按下列要求各举一例(即每小题分别写出符合题意的两种粒子):
(1)Z、n、b相同而A不同_____________________________。
(2)A、n、b相同而Z不同_____________________________。
(3)A、Z、b相同而n不同_____________________________。
(4)A、Z、n相同而b不同_____________________________。
解析:(1)要求Z相同而A不同,应是同位素原子;(2)要求Z不同而A相同,应该是质量数相同的不同元素的原子;(3)n是离子的电荷数,要求Z相同而n不同,可以是同一元素的不同价态的离子;(4)A、Z、n相同而b不同,应该是同一元素的不同分子或离子。
答案:(1) 和
和
(2) 和
和
(3)Fe2+和Fe3+
(4)O2和O3,或O2-和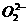
7.最近医学界通过用14C标记的C60发现一种C60的羧酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60的碳原子化学性质不同
B.与14N含的中子数相同
C.是12C60的同素异形体
D.与12C、13C互为同位素
解析:14C是碳元素的一种同位素,原子核内有14-6=8个中子,12C60是由碳元素原子组成的单质,与金刚石、石墨等属于同素异形体。同位素原子的中子数不同,但最外层电子数相同,故化学性质几乎完全相同。
答案:D
6.具有相同电子层结构的三种粒子An+、Bn-、C,下列分析正确的是( )
A.原子序数关系是C>B>A
B.粒子半径关系是Bn-<An+
C.C一定是稀有气体元素的一种原子
D.原子半径关系是A<C<B
解析:设C的原子序数为m,则A为m+n,B为m-n,所以原子序数为A>C>B。粒子半径:Bn->An+。Bn-为稀有气体电子层结构,而C又与之相同,所以C为稀有气体,又B与C在同一周期,故半径为C>B。
答案:C
5.(2010山东名校联考)已知A、B、C、D四种元素的电子层数均不超过3层,A元素原子的最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子次外层电子数等于其原子电子总数的一半;D元素原子最外层只有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素的核电荷数的关系中能够成立的是( )
①C>D>B>A ②D>B>A>C ③A>D>C>B ④B>A>C>D
A.只有① B.只有③ C.①② D.②④
解析:根据原子核外电子排布的规律,因A元素原子的最外层电子数是次外层电子数的2倍,所以A元素为碳元素;B元素原子最外层电子数是其内层电子总数的3倍,所以B元素为氧元素;C元素原子次外层电子数等于其原子核外电子总数的一半,所以C为Be或S;D元素原子最外层只有1个电子,D的阳离子与B的阴离子电子层结构相同,所以D为钠元素,因此核电荷数关系为C>D>B>A或D>B>A>C。故C项正确。
答案:C
4.(2010辽宁沈阳检测)下列各项对氧的三种同位素16O、17O、18O的原子均不同的是( )
A.核电荷数 B.中子数 C.电子层数 D.元素种类
答案:B
3.(2010天津河西检测)短周期主族元素的原子中,前者一定大于后者的是( )
A.中子数、质子数
B.质量数、核电荷数
C.最高正化合价数、负化合价数
D.核外电子数、主族序数
解析:A=Z+N,N≥0。在 中A=Z,因此谈“一定”,B有疑。C中碳元素有+4、-4两价,值相等。
中A=Z,因此谈“一定”,B有疑。C中碳元素有+4、-4两价,值相等。
答案:B
2.据报道,1996年2月欧洲一科学家小组,由66Zn和208Pb两原子经过核聚合,并放出一定数目的中子而制得的第112号元素的质量数为227的同位素。两原子在核聚合过程中放出的中子数是( )
A.47 B.115 C.142 D.162
解析:据守恒知66Zn和208Pb聚合后质量数减少了66+208-227=47,即为放出的中子数。
答案:A
1.下列说法不正确的是( )
①质子数相同的粒子一定是同种元素 ②同位素的性质几乎相同 ③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A.②③⑤⑥ B.①②④⑤ C.①②⑤⑥ D.③④⑤⑥
解析:粒子包括分子、离子、原子、质子、中子等,如H2O与Ne电子数、质子数均相同, 、
、 粒子是同一元素,故①错,④对;一种分子和一种离子,如果质子数相等,其电子数一定不等,故③对;同位素化学性质几乎相同,物理性质不同,质量数针对某原子而言,一种元素往往有几种同位素原子,它们的质量数各不相同。
粒子是同一元素,故①错,④对;一种分子和一种离子,如果质子数相等,其电子数一定不等,故③对;同位素化学性质几乎相同,物理性质不同,质量数针对某原子而言,一种元素往往有几种同位素原子,它们的质量数各不相同。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com