
题目列表(包括答案和解析)
2.物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
[注意]书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
2.水解理论:
⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。
[分析]因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-,
+
2H2O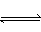 2OH-+2H+,
2OH-+2H+,
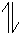
2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。
⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);
⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如Na2CO3溶液中微粒浓度关系。
[分析]因碳酸钠溶液水解平衡为:CO32-+H2O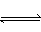 HCO3-+OH-,H2O+HCO3-
HCO3-+OH-,H2O+HCO3-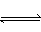 H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)。
H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)。
1.电离理论:
⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。
[分析]由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O 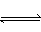 NH4++OH-,H2O
NH4++OH-,H2O 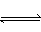 H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。
[分析]由于H2S溶液中存在下列平衡:H2S 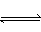 HS-+H+,HS-
HS-+H+,HS- 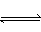 S2-+H+,H2O
S2-+H+,H2O 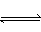 H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。
H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。
11.已知香豆素是一种广泛使用的香料,其结构简式为: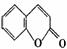
提示:有机物CXHYOZ的不饱和度Ω=x+1- ,
,
CH3CHO+CH3CHO CH3CH=CHCHO,试回答:
CH3CH=CHCHO,试回答:
(1)香豆素的分子式为 ,不饱和度Ω 。
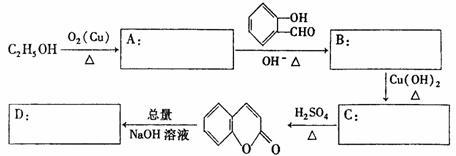 (2)现提供乙醇、水杨醛及必要的无机试剂,合成香豆素,其路线如下表所示,请在方框内填写A→D的结构简式:
(2)现提供乙醇、水杨醛及必要的无机试剂,合成香豆素,其路线如下表所示,请在方框内填写A→D的结构简式:
(3)为确定化合物B中是否含有“-OH”的官能团,加入的试剂是 ,可能的现象是 。
(4)写出下列反应的化学方程式:
A B
B
B C
C
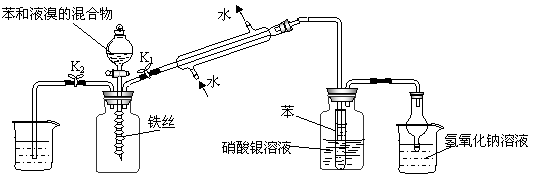
10.某校学生为探究苯与溴发生反应的原理,用如图装置进行实验。
 (I) (II) (III) (IV)
(I) (II) (III) (IV)
根据相关知识回答下列问题:
(1)装置(II)中发生反应的化学方程式为 。
(2)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅲ)中可能观察的现象是 。
(3)整套实验装置中能防止倒吸的装置有 (填装置序号)。
(4)装置(Ⅲ)冷凝管的作用是 ;(IV)中烧杯中的液体的作用是 。
(5)反应结束后要使装置I中的水倒吸入装置Ⅱ中。这样操作的目的是
,简述这一操作方法
。
(6)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是
。
9.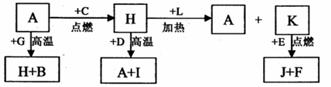 A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素: D 元素和 E 元素在周期表中相邻,
G、 H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体, H 是黑色晶体,以上物质相互间的转化关系如下图所示:
A、B、C、D、E、F 是常见单质,其中 A 是用量最大,应用最广泛的金属;元素 D 是地壳中含量最多的金属元素: D 元素和 E 元素在周期表中相邻,
G、 H、l、J、K、L 是常见化合物,其中 G 在常温下是无色液体, H 是黑色晶体,以上物质相互间的转化关系如下图所示:
请回答下列问题:
(1)元素 A 在元素周期表中的位置为__________(周期)__________(族)。
(2)写出 K 的电子式___________________。
(3)写出 H 和 D 反应的化学方程式_______________________________。
(4)D 能与氢氧化钠溶液反应,请写出该反应的离子方程式:
_____________________________________________。
(5)写出 A 与 G 反应的化学方程式____________________________________。
(6)K 与 E 反应时产生的现象有_____________________________________,
该反应的化学方程式为_______________________________________________。
8.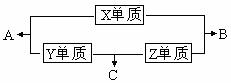 X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、M三种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个。而M的单质在常温常压下为固体,并且M元素是形成化合物种类最多的元素。请回答下列问题:
(1)元素X在周期表中的位置____________________________。
(2)化合物C在一定条件下生成化合物A的化学方程式_________________________。
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,得到pH=5的溶液,反应后的溶液存在的平衡体系有____________________________;溶液中离子浓度由大到小的顺序为___________________________。
(4)实验室里为制取C,常在C的浓溶液中加入生石灰。请叙述产生C的原因___________________________________________________________________________________________________________________________。
(5)已知Y单质和Z单质生成C的反应是可逆反应,△H<0。将等物质的量的单质Y和单质Z充入一密闭容器中,在适当催化剂和恒温条件下反应。下列说法中正确的是______
a.达到化学平衡时,正反应与逆反应速率相等
b.反应过程中,单质Y的体积分数始终为50%
c.达到化学平衡时,Y单质和Z单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,气体的平均相对分子质量逐渐增大
e. 达到化学平衡时,再升高温度,C的体积分数增大
(6)由X、Z、M三种元素可以形成化合物M2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则发生的有关化学方程式为_________________________。
7.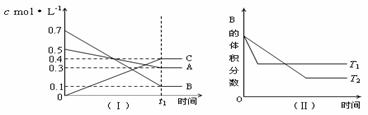 T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正逆反应速率均增大,且A的转化率增大
6.下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中
c(NH4+):①<③<②
D.等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N后< N前
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com