
题目列表(包括答案和解析)
10.下列化合物SOI2、SOBr2、SOCl2、SO2ClF、SF4、SBrF5、SOBrCl在水中容易水解,但不发生氧化还原反应,所有产物都是可溶的。现将其中的一种化合物A配成溶液,稀释后分成几份,分别加入一系列0.1 mol·L-1的试剂。列表如下:
|
加入试剂 |
测出结果 |
实验结论 |
|
硝酸和硝酸银 |
产生淡黄色沉淀 |
(a) |
|
氯化钡 |
无沉淀 |
|
|
溶液微热后,再用NH3将pH调到7,然后加入硝酸钙 |
无明显反应 |
(b) |
|
向该物质的酸性溶液中加入高锰酸钾,然后加入硝酸钡 |
高锰酸钾的特征颜色消失,加入硝酸钡后产生白色沉淀 |
|
|
氯化铁、四氯化碳 |
四氯化碳层不显紫色 |
(c) |
据测试结果:(1)填写表中(a)(b)(c)的实验结论。
(2)该化合物的化学式可能是___________________。
解析:由①可知,溶液中含有Br-,可能含有Cl-。由②可知溶液中无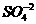 。根据③中现象可知溶液中不含有F-,因为CaF2难溶于水。由④可知原溶液含有还原性的离子
。根据③中现象可知溶液中不含有F-,因为CaF2难溶于水。由④可知原溶液含有还原性的离子 ,被氧化后,与Ba(NO3)2作用产生白色沉淀。由⑤可知溶液中不含有I-。综上所述,原化合物中一定含有Br、S元素,不含有F、I元素,可能的化学式为SOBr2和SOBrCl。
,被氧化后,与Ba(NO3)2作用产生白色沉淀。由⑤可知溶液中不含有I-。综上所述,原化合物中一定含有Br、S元素,不含有F、I元素,可能的化学式为SOBr2和SOBrCl。
答案:(1)(a)可能含有Br-、Cl-
(b)排除F- (c)排除I-
(2)SOBr2和SOBrCl
9.分离KNO3与NaCl固体混合物的实验步骤如下:
①将混合物用蒸馏水溶解制成饱和溶液
②将滤液冷却,结晶,分离出晶体
③趁热过滤,滤出析出的晶体
④加热蒸发,至有较多晶体析出
完成下列问题:
(1)正确操作步骤的顺序是(用序号填空)______________。
(2)趁热滤出的晶体是____________;趁热过滤的理由是________________________。
(3)滤液为何需冷却结晶:__________________________________________________。
(4)欲得更纯的KNO3晶体,还需进行的是______________________________________。
解析:因为KNO3的溶解度受温度影响较大,而NaCl溶解度受温度影响较小,可在常温下将它们溶解形成饱和溶液,然后加热蒸发,水量减少,氯化钠晶体析出,因温度升高,KNO3不会析出。为防止KNO3的析出,要趁热过滤,得到的滤渣为NaCl,滤液为KNO3的浓溶液。将滤液冷却,析出KNO3,过滤,得到的KNO3晶体中混有少量的NaCl杂质,通过重结晶的方法进一步对其提纯。
答案:(1)①④③②
(2)NaCl NaCl的溶解度受温度影响小,加热蒸发溶剂时结晶析出,若不趁热过滤,则降温时,KNO3也会结晶析出
(3)KNO3在温度下降时,溶解度减小,会结晶析出
(4)重结晶
8.为了除去粗盐中Ca2+、Mg2+和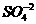 及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量的盐酸 ④加过量Na2CO3溶液 ⑤加过量的BaCl2溶液
A.①④②⑤③ B.②⑤④①③
C.④①②⑤③ D.①②③④⑤
解析:根据除杂原理,应把除固体杂质的操作放在杂质变成沉淀后,过滤之后加HCl除去多余Na2CO3。由此可推断出操作顺序为B。
答案:B
7.(2010天津高考,10)下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
解析:在Al3+、Fe3+的混合溶液中加入过量氨水,生成Al(OH)3、Fe(OH)3沉淀,不能将Al3+、Fe3+分离;N2、O2的混合气体通过灼热的铜网,发生反应2Cu+O2====2CuO,O2被除去;乙醇中含有的少量水不能直接用蒸馏的方法除去,应先加入CaO再蒸馏;在AgCl、Ag2CO3混合物中加入HCl,发生反应Ag2CO3+2HCl====2AgCl+H2O+CO2↑,经过滤可得纯净的AgCl。
答案:A
6.下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液;②用盐析法分离出皂化反应产生的高级脂肪酸钠;③用升华法分离I2和沙子的混合物;④用重结晶法分离KNO3和NaCl的混合物;⑤用分液法分离H2O和C2H5Br的混合物;⑥用蒸馏法分离C2H5OH与H2O的混合物。你认为上述方法( )
A.只有①不正确 B.②⑤⑥不正确
C.只有②③⑥正确 D.全部正确
解析:①中蛋白质溶液是一种胶体,而葡萄糖溶液不是,可用渗析法进行分离;②中向混合液中加入食盐,使高级脂肪酸钠的溶解度降低而析出来达到分离的目的;⑥中乙醇和水的沸点不同,可用蒸馏法分离;⑤中溴乙烷密度比水大,难溶于水,可用分液法进行分离。
答案:D
5.下列各组气体或溶液用括号内试剂加以鉴别,其中不合理的是( )
A.二氧化碳、二氧化硫、一氧化碳(品红试液)
B.氯化钠、硝酸银、碳酸钠(稀盐酸)
C.酒精、醋酸、醋酸钠(石蕊试液)
D.硫酸、硝酸钡、氯化钾(碳酸钠溶液)
解析:A选项中,二氧化碳和一氧化碳分别通入品红试液时,品红试液均无明显变化,二氧化硫通入品红试液时,品红褪色,即用品红试液不能鉴别二氧化碳和一氧化碳,A选项符合题意;B选项中,将稀盐酸分别滴入三种溶液时,氯化钠溶液无明显变化,硝酸银溶液中出现白色沉淀,碳酸钠溶液中产生无色气体,故B选项不符合题意;C选项中,酒精遇石蕊无明显变化,醋酸能使紫色石蕊变红色,醋酸钠属强碱弱酸盐,在水溶液中发生水解而显碱性,能使紫色石蕊变蓝色,故C选项不符合题意;D选项中硫酸与碳酸钠反应产生CO2气体,硝酸钡与碳酸钠反应产生BaCO3沉淀,氯化钾与碳酸钠不反应,故D选项不符合题意。
答案:A
4.现有①Al2(SO4)3、②Ba(NO3)2、③NaOH、④CuCl2、⑤KCl等5种溶液,不加任何试剂就可鉴别出的先后顺序正确的是( )
A.④③①②⑤ B.③①④②⑤
C.②③④①⑤ D.⑤④③②①②
解析:先观察试样颜色找出CuCl2,再在余下的四种无色溶液中加入CuCl2溶液,找出NaOH溶液,再利用氢氧化钠溶液加入余下的3种溶液中,找出硫酸铝溶液,再用硫酸铝作试剂找出硝酸钡和氯化钾。
答案:A
3.常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
A.MnO2 CuO FeO B.(NH4)2SO4 K2SO4 NH4Cl
C.AgNO3 KNO3 Na2CO3 D.Na2CO3 NaHCO3 K2CO3
解析:A项物质可利用浓盐酸区别开来;B项利用Ba(OH)2溶液区别;C项可利用稀盐酸区分;只有D项不能用一种试剂进行区别。
答案:D
2.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂不能选用的是( )
A.溴水 B.FeCl3溶液
C.KMnO4酸性溶液 D.AgNO3溶液
解析:A、B、C三项可根据呈现不同现象来鉴别所给五种溶液;而AgNO3溶液遇到NaCl溶液和Na2SO3溶液时,均产生白色沉淀,只用AgNO3无法区分五种溶液,故D不能选用。
答案:D
1.下列各组物质中,不易用物理性质区别的是( )
A.苯和四氯化碳 B.酒精和汽油
C.氯化铵和硝酸铵晶体 D.碘和高锰酸钾固体
解析:苯和四氯化碳可以根据水溶性及密度大小进行区别;酒精和汽油以及碘和高锰酸钾固体均可以根据水溶性区别;氯化铵和硝酸铵晶体颜色相似,水溶性相似,且溶于水均吸热,较难用物理性质区别。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com