
题目列表(包括答案和解析)
4.(2010天津河西检测)下列反应的离子方程式正确的是( )
A.用Pt电极电解MgCl2溶液:2H2O+2Cl- H2+Cl2↑+2OH-
H2+Cl2↑+2OH-
B.向FeBr2溶液中通入少量Cl2:2Br-+Cl2====2Cl-+Br2
C.向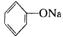 溶液中通入少量CO2:
溶液中通入少量CO2:
 +CO2+H2O
+CO2+H2O
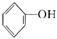 +
+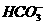
D.Al(NO3)3溶液中加入过量的氨水:
Al3++4NH3·H2O====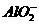 +4
+4 +2H2O
+2H2O
解析:A项电解产生的OH-遇Mg2+应产生Mg(OH)2沉淀,故应为
Mg2++2Cl-+2H2O Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B项中还原性Fe2+>Br-,则通入Cl2应先氧化Fe2+,应为
2Fe2++Cl2====2Fe3++2Cl-
D项Al(OH)3不溶于过量的氨水中,应为
Al3++3NH3·H2O====Al(OH)3↓+3
答案:C
3.(2010江苏高考,9)下列离子方程式正确的是( )
A.碳酸氢钠溶液与少量石灰水反应:
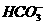 +Ca2++OH-=====CaCO3↓+H2O
+Ca2++OH-=====CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:
OH‑+
 H2O+NH3↑
H2O+NH3↑
C.氢氧化镁与稀硫酸反应:
H++OH-====H2O
D.单质铜与稀硝酸反应:
Cu+2H++2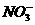 ====Cu2++2NO↑+H2O
====Cu2++2NO↑+H2O
解析:本题主要考查离子反应方程式的书写是否正确。NaHCO3与石灰水的反应与反应物的用量有关,若Ca(OH)2不足,则发生反应Ca2++2OH-+2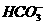 ====CaCO3↓+2H2O+
====CaCO3↓+2H2O+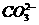 ;若Ca(OH)2过量,则反应为
;若Ca(OH)2过量,则反应为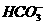 +OH-+Ca2+====CaCO3↓+H2O,故A不正确。NH3·H2O不稳定,故将NH4Cl和NaOH混合共热,NH3应以气体形式放出,B正确。Mg(OH)2难溶于水,改写时应写成化学式,C不正确。显然D选项电荷不守恒。
+OH-+Ca2+====CaCO3↓+H2O,故A不正确。NH3·H2O不稳定,故将NH4Cl和NaOH混合共热,NH3应以气体形式放出,B正确。Mg(OH)2难溶于水,改写时应写成化学式,C不正确。显然D选项电荷不守恒。
答案:B
2.电解质是( )
A.导电性很强的物质
B.在溶于水或熔化状态下能导电的化合物
C.在溶于水或熔化状态下全部电离的化合物
D.可溶性盐类
解析:电解质的概念中有两个要素:一是化合物,二是在水溶液中或熔化状态下能够导电。是电解质发生电离,但并不一定是电解质全部电离。可溶性盐类是电解质,但它不是电解质的全部。
答案:B
1.(2010北京西城检测)某无色透明的强酸性溶液中,能大量共存的一组离子是( )
A.Mg2+、Al3+、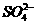 、
、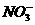 B.Na+、
B.Na+、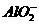 、K+、
、K+、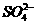
C.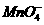 、K+、
、K+、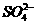 、Na+
D.
、Na+
D. 、
、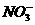 、Fe2+、Cl-
、Fe2+、Cl-
解析:本题考查离子共存的知识,条件是无色酸性溶液,B中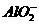 不能共存,C中有颜色,D中Fe2+
与
不能共存,C中有颜色,D中Fe2+
与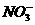 不能共存。A正确。
不能共存。A正确。
答案:A
11.有100 mL混合气体,可能由NH3、HCl、CO2和NO组成,把混合气体通过浓H2SO4,气体体积减少30 mL,再经过Na2O2,气体又减少30 mL,最后经过水,剩余气体为20 mL(均在同温同压下测定,且不考虑水蒸气体积)。问:
(1)该混合气体由哪些气体混合而成?各占多少毫升?
(2)最后剩余20 mL是什么气体?简要说明理由。
解析:混合气体通过浓H2SO4,体积减少30 mL,即V(NH3)=30 mL,由NH3的存在知不可能有HCl气体,则剩余气体为CO2和NO体积为100 mL-30 mL=70 mL
设CO2体积为x,则NO为(70 mL-x),
由反应方程式:2CO2+2Na2O2====2Na2CO3+O2可知生成的O2体积为 。
。
①若氧气过量
2NO + O2 ==== 2NO2
2 1 2
70 mL-x 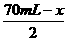 70 mL-x
70 mL-x
所以有 -
-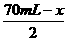 +70 mL=40 mL
+70 mL=40 mL
解之,不合理。
②若NO过量,依题意有
2NO+O2====2NO2
2 1 2
x  x
x
(70 mL-x)-x+x=40 mL
所以x=30 mL
即V(CO2)=30 mL
V(NO)=70 mL-30 mL=40 mL
由上可知NO过量了10 mL,生成了30 mL NO2,经过水后,最后剩余的20 mL气体为NO,因为由
3NO2+H2O====2HNO3+NO
30 10
生成了10 mL NO,加上过量的10 mL,共20 mL NO。
答案:(1)混合气体由NH3、CO2、NO组成,其中V(NH3)=30 mL,
V(CO2)=30 mL,V(NO)=40 mL。
(2)最后剩余的20 mL气体为NO。
10.图8-3是某气体X产生并研究其性质的装置。
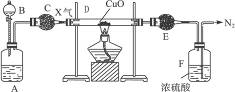
图8-3
A中盛有微溶的白色固体,B中盛有无色挥发性液体,C和E中盛有干燥剂。A和B中物质相遇时有无色气体X生成,它经图中一系列装置在末端得到N2,且E管的质量增加。
(1)写出盛放试剂的名称:
A.____________,B.____________,C.____________,E.____________。
(2)A和B中物质相遇生成X的主要原因是:________________________。
(3)D中反应的化学方程式_________________________________________。
(4)F中反应的化学方程式_________________________________________。
(5)从D中反应说明气体X具有____________(填“酸性”“碱性”“氧化性”或“还原性”)。
解析:从末端的N2逆推可知X中含N元素。从E增重可推导D中反应有水生成。N2和H2O均由D中反应而来,初步判断D中CuO与含N、H元素的物质X作用,猜想X为NH3。A、B相遇得NH3,B应盛有浓氨水,A中应盛固体NaOH或CaO,因题给物质微溶,可知它是CaO。最后全面检查验证。
答案:(1)生石灰 浓氨水 碱石灰 碱石灰
(2)CaO与水化合生成熟石灰,消耗水并放出大量热,使浓氨水中的NH3逸出
(3)3CuO+2NH3 N2+3Cu+3H2O
N2+3Cu+3H2O
(4)2NH3+H2SO4====(NH4)2SO4
(5)还原性
9.(2010湖北黄冈高三模拟)下图中A-J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
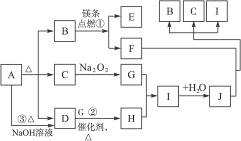
请填写以下空白:
(1)B的电子式为____________,D分子的空间构型为____________。
(2)写出反应①②的化学方程式:
①___________________________________________;
②___________________________________________。
(3)反应③的离子方程式为:_______________________________。
解析:A受热分解得到相同物质的量的三种物质,且能够和氢氧化钠反应生成D,D接着在催化剂的条件下和G反应,考虑是NH3的性质;C能够和过氧化钠反应,假设为水或者二氧化碳;B则综合考虑是二氧化碳。
答案:(1)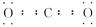 三角锥形
三角锥形
(2)2Mg+CO2 2MgO+C
2MgO+C
4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)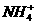 +
+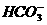 +2OH-
+2OH- NH3↑+
NH3↑+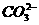 +2H2O
+2H2O
8.A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请完成以下问题:
(1)B的电子式为___________,A的结构式为___________,A分子的空间构型是__________;
(2)写出②中涉及反应的化学方程式____________________________________;
(3)由B反应生成1 mol A放出的热量为46.2 kJ,写出该反应的热化学方程式,并注明反应条件________________________;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式________________________。
解析:由题意可知元素Y具有多种可变的化合价,A为NH3,元素Y为氮元素。E中氮元素的价态最高,故E为HNO3,B为单质氮气。D通入水中生成C和HNO3,则D为NO2,C为NO。由于N2和H2反应生成1 mol NH3时,放出的热量为46.2 kJ,其热化学方程式是: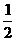 N2(g)+
N2(g)+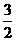 H2(g)
H2(g) NH3(g);ΔH=-46.2 kJ·mol-1或N2(g)+3H2(g)
NH3(g);ΔH=-46.2 kJ·mol-1或N2(g)+3H2(g) 2NH3;ΔH=-92.4 kJ·mol-1。氯气具有强氧化性,可把氨气氧化为N2:3Cl2+8NH3====6NH4Cl+N2。
2NH3;ΔH=-92.4 kJ·mol-1。氯气具有强氧化性,可把氨气氧化为N2:3Cl2+8NH3====6NH4Cl+N2。
答案:(1)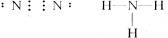 三角锥形
三角锥形
(2)3NO2+H2O====NO+2HNO3
(3)N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1
2NH3(g);ΔH=-92.4 kJ·mol-1
(4)8NH3+3Cl2====6NH4Cl+N2
7.(2010北京春季高考,27)A、B、C、D为常见气态单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请完成下列问题:
(1)C和D反应生成的化合物的电子式是_______________________。
(2)上述②中化合物的热稳定性_______________强于_______________。(填写化学式)
(3)将D通入B、C生成的化合物中,发生反应的化学方程式是________________________。
(4)A、C、D所含元素可组成一种离子化合物,该化合物发生水解反应的离子方程式是____________________________________。
解析:因为A和B可以在放电的条件下发生化合反应,其产物还可与B化合生成红棕色气体,所以A为N2,B为O2。C分别与N2、O2反应生成10e-化合物,则C为H2。D与H2反应生成化合物易溶于水,且与AgNO3溶液反应产生白色沉淀,D为Cl2。
答案:(1)
(2)H2O NH3
(3)Cl2+H2O====HCl+HClO
(4)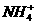 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
6.A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B,按图8-2所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉。
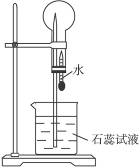
图8-2
(1)A的化学式是_____________________________。
(2)可用于除去B中水分的干燥剂是_____________。收集气体B的方法是_______________。
(3)收集气体C的方法是________________________________________________________。
解析:此题为一推断型的实验题。由题给条件可知,B为NH3,C为HCl气体,所以A为NH4Cl。NH3为碱性气体,只能用碱石灰或生石灰、KOH固体等不与氨反应的干燥剂干燥。氨气的密度比空气小,应用向下排空气法收集;氯化氢气体的密度比空气的大,应用向上排空气法收集。
答案:(1)NH4Cl (2)碱石灰(或答生石灰、KOH固体等任一种不与氨反应的干燥剂) 向下排气法 (3)向上排气法
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com