
题目列表(包括答案和解析)
6.使9 g乙二酸和某一定量二元醇完全酯化,生成W g酯和3.6 g水,则该醇的相对分子质量为( )
A. B.
C. D.
解析:本题重点考查了酯化反应的原理。一元羧酸跟一元醇发生酯化反应时,反应的一元羧酸、一元醇,生成的酯和水的物质的量之比为1∶1∶1∶1。二元羧酸与二元醇完全发生酯化反应时,反应的二元羧酸、二元醇,生成的酯和水的物质的量之比为1∶1∶1∶2,设此二元醇的化学式为CnH2n+2O2,则此酯化反应的化学方程式为:
C2H2O4+CnH2n+2O2―→Cn+2H2nO4+2H2O
根据质量守恒,可知醇的质量为(W+3.6-9) g,二元醇的物质的量等于乙二酸的物质的量=0.1 mol。
则二元醇的相对分子质量为。
答案:B
5.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种化学式为C6H14O的物质。对于此过程,以下分析中不正确的是( )
A.C6H14O分子含有羟基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量分解
解析:酯水解生成酸和醇,因此C6H14O中存在-OH,能与Na发生反应;根据酯化反应原理,该酯的结构简式可表示为CH3COOC6H13,其水解需要酸等做催化剂。
答案:D
4.(2009·广东深圳)下列说法正确的是( )
A.醋酸纤维、橡胶、腈纶都属于合成高分子化合物
B.加新制的Cu(OH)2悬浊液并加热可检验尿液中的葡萄糖
C.油脂在酸的催化作用下可发生水解,工业上利用该反应生产肥皂
D.向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯
解析:A中醋酸纤维是纤维素乙酸酯的俗称,属于天然高聚物。B中葡萄糖中含有醛基,可用新制氢氧化铜鉴别。C中工业上制肥皂是油脂在碱的催化作用下发生水解,C错。D中硫酸铜会使蛋白质变性,故D错。
答案:B
3.(2009·广东六校)食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是( )
A.PE、PVC都属于线型高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体HCl
D.废弃的PE、PVC均可回收利用以减少白色污染
解析:聚乙烯、聚氯乙烯都属于线型高分子,具有热塑性,A项正确;PVC的单体是CH2===CHCl,不属于烃,B项错误;PVC中含有氯元素,在燃烧过程中会产生HCl,对人体有害,C项正确;废弃塑料可造成白色污染,回收利用可减少环境污染,D项正确。
答案:B
2.(2009·南昌二中模拟)2007年1月1日,我国科学家在全球率先发现了有效治疗Ⅱ型糖尿病的神奇分子--非肽类分子激动剂(代号为Boc5,化学式为C54H52N4O16S2),它的神奇之处在于能模拟人体内的某些大分子,促进人体的胰岛素分泌,发挥对血糖的调节作用,这一发现将为千百万Ⅱ型糖尿病患者解除病痛。下列有关说法正确的是( )
A.Boc5中一定不含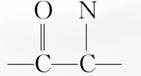
B.葡萄糖、麦芽糖、蔗糖均能与新制氢氧化铜反应生成Cu2O
C.Boc5是高分子化合物
D.糖类的通式均满足(CH2O)n
解析:题目所给信息说明此有机物为非肽类分子,所以不含有肽键;蔗糖不能发生银镜反应;此物质的相对分子质量不够几万,所以不属于高分子化合物;糖类不一定都满足(CH2O)n的通式。
答案:A
1.(2009·中山纪念中学模拟)下列说法正确的是( )
A.蛋白质属于天然高分子化合物,组成元素只有C、H、O、N
B.用浓Na2SO4、CuSO4溶液或浓HNO3溶液使蛋清液发生盐析,进而分离、提纯蛋白质
C.蛋白酶是蛋白质,它不仅可以催化蛋白质的水解反应,还可以催化淀粉的水解反应
D.甘氨酸(H2N-CH2-COOH)既有酸性、又有碱性,是最简单的氨基酸
解析:组成蛋白质的元素还有S和P等;Cu2+可以使蛋白质变性,而浓硝酸则可以与蛋白质发生显色反应;酶的催化具有专一性,蛋白酶只能催化蛋白质水解。
答案:D
22.(2008·全国理综Ⅱ)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是__________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是________________;上述分解反应是一个可逆反应,温度为T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于______;
若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2__________α1(填“大于”“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________,P和Cl2一步反应生成1 mol PCl5的ΔH4__________ΔH3(填“大于”“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________。
解析:本题考查反应热的本质、热化学方程式的书写、反应热计算、化学平衡、水解等知识。
(1)PCl3为Cl2和P反应的中间产物,图示中的ΔH1=-306 kJ/mol表示1 mol P(s)反应生成1 mol PCl3(g)放出的热量,再根据热化学方程式的书写原则可得其热化学方程式为:P(s)+Cl2(g)===PCl3(g) ΔH=-306 kJ/mol。
(2)图示中的ΔH2=-93 kJ/mol,表示1 mol PCl3(g)与1 mol Cl2(g)反应生成1 mol PCl5(g)放出的热量,故1 mol PCl5(g)分解产生1 mol PCl3(g)与1 mol Cl2(g)吸收93 kJ热量,故有:PCl5(g)===Cl2(g)+PCl3(g) ΔH=+93 kJ/mol。α1=×100%=25%。因PCl5(g)的分解反应是吸热反应,故升温PCl5(g)的转化率增大,即α2>α1。
(3)因Cl2与P生成PCl3、PCl3与Cl2反应生成PCl5都是放热反应,降温有利于提高反应物的转化率且能防止产物分解。
(4)根据盖斯定律有ΔH4=ΔH3=ΔH1+ΔH2=-306 kJ/mol-93 kJ/mol=-399 kJ/mol。
(5)PCl5发生水解生成H3PO4和HCl两种酸:PCl5+4H2O===5HCl+H3PO4。
答案:(1)Cl2(g)+P(s)===PCl3(g) ΔH=-306 kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93 kJ/mol 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ/mol 等于
(5)PCl5+4H2O===H3PO4+5HCl
21.(2009·原创卷)“神舟”七号于2008年9月25日晚21时10分04秒在酒泉卫星发射中心发射升空,9月27日下午16时30分航天员翟志刚首次进行出舱活动,成为我国太空行走第一人,这标志着我国航天技术走在了世界前列。请回答下列与航天技术有关的试题:
(1)在发射“神舟”七号的火箭推进器中装有肼(N2H4)和过氧化氢,当两者混合时即产生气体,并放出大量的热。已知:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ/mol
H2O(l)===H2O(g) ΔH=+44 kJ/mol
若用6.4 g液态肼与足量过氧化氢反应生成氮气和液态水,则整个过程中转移的电子的物质的量为__________,放出的热量为__________。
(2)我国“长征三号甲”运载火箭一级推进剂也采用四氧化二氮作为氧化剂,燃料是液态偏二甲肼(C2H8N2),火箭起飞时的反应产物都是无毒的气体。
请你写出该反应的化学方程式:______________________。请你解释火箭上升过程中“尾巴”是红棕色的原因:________________________。
(3)未来的“神舟”八号将组建成中国的空间站,届时空间站需要再生性的燃料电池。这种电池的基本原理是有太阳光时利用太阳能电池板收集的电能将水电解(2H2O电解2H2↑+O2↑),没有太阳光时利用燃料(H2)、氧化剂(O2)构成原电池,提供电能。若用KOH浓溶液作为电解液,请写出该原电池负极的反应式:____________________。
(4)飞船或空间站中的宇航员新陈代谢的气体是二氧化碳、水蒸气,而呼吸需要的则是氧气。请你利用自己所学的化学知识设计一个能够循环处理飞船或空间站内气体的方法(写出化学方程式即可):________________________。
解析:(1)6.4 g液态肼的物质的量为0.2 mol,1 mol液态肼完全被过氧化氢氧化为氮气与水蒸气时,转移的电子为4 mol,故6.4 g液态肼转移的电子为0.8 mol;由盖斯定律可知,液态肼与过氧化氢反应生成氮气和液态水的热化学方程式:N2H4(l)+2H2O2(l)===N2(g)+4H2O(l) ΔH=-817.6 kJ·mol-1,故0.2 mol液态肼放出的热量为0.2 mol×817.6 kJ/mol=163.5 kJ。(2)四氧化二氮与偏二甲肼反应的产物为二氧化碳、氮气和水;火箭上升过程中,泄漏出的四氧化二氮分解产生二氧化氮,红棕色即为二氧化氮的颜色。(3)该燃料电池的负极反应式为:H2+2OH--2e-===2H2O。(4)利用Na2O2与二氧化碳、水蒸气反应生成氧气的原理可以处理飞船或空间站中人体新陈代谢产生的“废气”。
答案:(1)0.8 mol 163.5 kJ
(2)C2H8N2+2N2O4===2CO2+4H2O+3N2 四氧化二氮分解产生红棕色的二氧化氮 (3)H2+2OH--2e-===2H2O (4)2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2
20.《全球科技经济瞭望》报道了美国氢燃料电池技术的发展。科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量。即:H2(g)+O2(g)===H2O(l) ΔH=-285.5 kJ/mol。
(1)试分析“氢能”将是未来21世纪最理想的新能源的原因________________________________________________;________________________________________________(指出两个优点即可)。
(2)目前世界上的氢气绝大部分是从石油、煤炭和天然气中制取。请写出工业上由天然气与H2O(g)反应制氢气的化学反应方程式______________________________________。
(3)利用硫-碘热循环法制取氢气也是化学家常用的一种方法,总反应方程式为2H2O2H2↑+O2↑,其循环过程分三步进行:
(a)SO2+I2+H2O―→(______)+(______)
(b)(______)―→______+______
(c)(______)―→______+______+______
完成以上三步反应,并确定最难进行的反应为__________。
答案:(1)燃烧值高 是清洁能源
(2)CH4+H2O高温CO+3H2
(3)(a)SO2+I2+2H2O===2HI+H2SO4
(b)2HI===H2+I2
(c)H2SO4===SO2+H2O+O2 (c)
19.某化学小组对生石灰与水反应是显著放热反应进行了实验探究,在除了用手触摸试管壁感觉发热外,还设计了下列几个可行性方案。
甲方案:将温度计与盛有生石灰的小试管用橡皮筋捆绑在一起,放入有水的小烧杯中,用胶头滴管向小试管中缓缓滴入水,看到的现象是______________________________________,________________________________,说明反应放热。(下列装置中支撑及捆绑等仪器已略去)
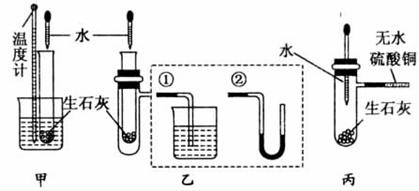
乙方案:将盛放有生石灰的小试管插入带支管的试管中,支管接①或②,用胶头滴管向小试管中缓缓滴入水,看到的现象是(接①)______________,(接②)____________________,说明反应放热。
丙方案:用胶头滴管向盛放有生石灰且带支管的试管中滴加水,支管接的导管中盛适量无水硫酸铜粉末,看到的现象是____________________________,说明反应放热,其原因是__________________________________________________。
解析:实验从反应放热的“热”为出发点进行探究,通过放热使温度上升、使气体膨胀、水被蒸发等特征现象,合理地设计了实验探究方案。
答案:方案甲:小试管中固体变成乳状,同时有大量水蒸气产生 温度计温度上升
方案乙:①有气泡产生 ②左边水柱下降,右边水柱上升
方案丙:无水硫酸铜粉末变蓝色 水和生石灰反应放出热量,使水蒸发
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com