
题目列表(包括答案和解析)
8.如图是吸热、放热反应的能量变化图,纵坐标表示能
量变化,横坐标表示反应的时间,其中能代表吸热反应的是( )
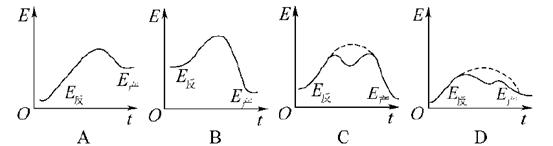
解析:B、C中反应物的能量高于产物的能量,为放热反应;A、D中反应物能量低于产物的能量,为吸热反应,其中C、D代表使用催化剂的情况,使用催化剂能够降低反应物发生反应所需的能量,使反应易于进行,但与反应热无关。
答案:AD
7.2007年3月,温家宝指出“优化结构、提高效益、降低消耗、保护环境”,这是我国国民经济和社会发展的基础性要求。你认为下列行为不符合这个要求的是( )
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.加快太阳能、风能、生物质能、海洋能等清洁能源的开发利用
C.研制开发以水代替有机溶剂的化工涂料
D.将煤转化成气体燃料可以有效地减少温室气体产生
解析:导致“温室效应”的气体主要是二氧化碳,将煤转化成气体燃料燃烧后不能减少二氧化碳的排放量。
答案:D
6.(2009·青岛高三质量检测)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ/mol
下列说法不正确的是( )
A.反应①②均为放热反应
B.反应①②转移的电子数相同
C.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH=-a kJ/mol,a<574
D.若用标准状况下4.48 LCH4通过上述反应还原NO2至N2,放出的热量为173.4 kJ
解析:因反应①和②的反应热均为负值,故该反应均为放热反应,A正确;因两个反应中均有1 mol CH4(g)完全反应其氧化产物均为CO2(g),故转移电子数也相同,B正确;因为等量的H2O(l)比H2O(g)能量低,故a>574,C不正确;D项中,根据盖斯定律,(①+②)/2有:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ/mol,则0.2 mol CH4反应释放出的热量为0.2 mol×867 kJ/mol=173.4 kJ,故选C。
答案:C
5.(2009·山东潍坊模拟)在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol/L NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol/L NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x)kJ/mol
B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y)kJ/mol
C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y)kJ/mol
D.2CO2(g)+2NaOH(l)===2NaHCO3(l) ΔH=-(8x-2y)kJ/mol
解析:0.5 mol CO2与0.75 mol NaOH反应生成0.25 mol Na2CO3和0.25 mol NaHCO3,反应所放出的热量为x kJ,则生成1 mol Na2CO3和1 mol NaHCO3放出4x kJ的热量。1 mol CO2通入含2 mol NaOH溶液中生成1 mol Na2CO3,放出y kJ的热量,则1 mol CO2与含1 mol NaOH的溶液反应所放出的热量为(4x-y) kJ,A项、B项均错;D项中Na2CO3与NaOH的状态未标对;只有C正确。
答案:C
4.(2009·广州二中等六校联考)已知下列两个气态物质之间的反应:
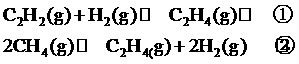
已知在降低温度时①式平衡向右移动,②式平衡向左 移动,则下列三个反应:(Q1、Q2、Q3均为正值)
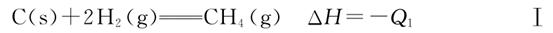 C(s)+H2(g)===C2H2(g) ΔH=-Q2Ⅱ
C(s)+H2(g)===C2H2(g) ΔH=-Q2Ⅱ
C(s)+H2(g)===C2H4(g) ΔH=-Q3Ⅲ
Q值大小比较正确的是( )
A.Q1>Q3>Q2 B.Q1>Q2>Q3
C.Q2>Q1>Q3 D.Q3>Q1>Q2
解析:由温度降低时,反应①平衡向右移动知,反应①正方向为放热反应,即ΔH1<0;由温度降低时,反应②平衡向左移动,反应②逆方向为放热反应,即ΔH2>0。结合三个反应,可得2(Ⅲ-Ⅱ)=ΔH1<0,即2(-Q3+Q2)<0,Q3>Q2;2(Ⅲ-Ⅰ)=ΔH2>0,即2(-Q3+Q1)>0,Q1>Q3,A项正确。
答案:A
3.下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.5 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ/mol,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的溶液混合,放出的热量要大于57.3 kJ
解析:A项中,硫蒸气放出的热量大于硫黄充分燃烧放出的热量,B项由反应热的定义知ΔH=571.6 kJ/mol,C项反应为吸热反应,故ΔH>0。
答案:D
2.(2009·广东惠州调研)石墨与金刚石都是碳的单质,工业上常用石墨在一定条件下转化为金刚石的反应原理生产人造钻石。已知12 g石墨完全转化成金刚石时需要吸收E kJ的能量。则下列说法正确的是( )
A.石墨不如金刚石稳定
B.金刚石不如石墨稳定
C.等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
D.等质量的石墨和金刚石完全燃烧,石墨放出的能量多
解析:石墨完全转化成金刚石时需要吸收能量,说明石墨的能量比金刚石低,故石墨比金刚石稳定,B对;由于金刚石的能量比石墨高,故等质量的石墨和金刚石完全燃烧,金刚石放出的能量多,C对。
答案:BC
1.(2009·海南万宁测试)合理利用燃料减小污染符合“绿色奥运”理念,下列关于燃料的说法正确的是( )
A.“可燃冰”是将水变为油的新型燃料
B.氢气是具有热值高、无污染等优点的燃料
C.乙醇是比汽油更环保、不可再生的燃料
D.石油和煤是工厂经常使用的可再生的化石燃料
解析:A项,不符合化学反应原理;C项,乙醇是可再生燃料;D项,石油和煤是不可再生燃料,只有B项正确。
答案:B
22.(2009·广东中山纪念中学)某研究性学习小组成员,利用稀硫酸与某金属的反应来探究影响化学反应速率的因素,下表是研究过程中记录的实验数据(表中某些数据记录已模糊不清,个别数据已丢失)。
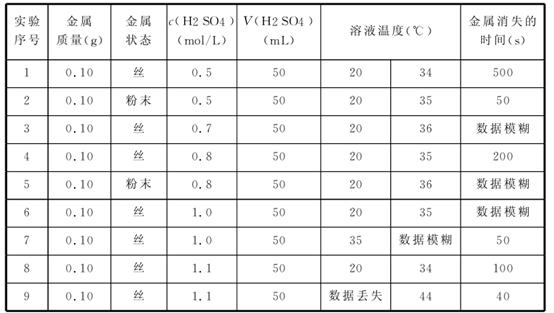
若实验操作、数据记录均是正确的,试分析上述数据回答下列问题:
(1)该实验主要是探究______________________________________对反应速率的影响。
(2)经仔细辨认,模糊的数据疑为25、50、125、250,试将这些疑似数据填入表中,使实验数据较为合理。
(3)试猜测实验9反应前溶液的温度约为______℃。推测的依据是__________________________________________________________。
解析:根据实验的条件找出相同的、不同的物理量,出现不同的物理量则是要探究的条件。金属的质量相同但状态不同,则探究其接触面积与反应速率的关系;硫酸的体积相同但浓度不同,所以考查了其浓度对反应速率的影响;溶液温度不同,所以探究温度对反应速率的影响。将三者影响因素综合考虑,可得出如下结论,金属表面积越大,反应速率越快;硫酸浓度越大,反应速率越快;温度越高,反应速率越快。
答案:(1)金属表面积、硫酸溶液浓度、反应温度
(2)
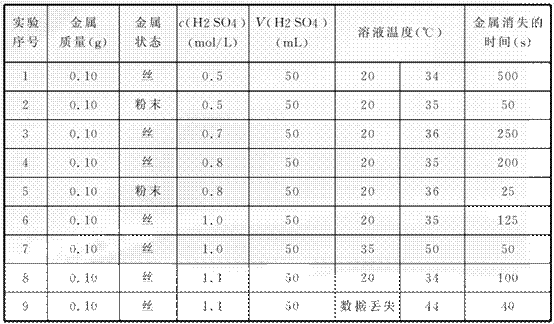
(3)30 等量的金属和酸反应放出的热量基本相同,使等量的溶液温度升高约15 ℃
21.(2009·宿迁模拟)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察下图,然后回答问题。
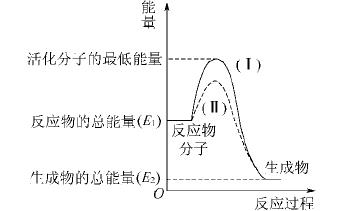
(1)图中所示的反应是__________(填“吸热”或“放热”)反应,该反应__________(填“需要”或“不需要”)加热,该反应的ΔH=________(用含E1、E2的代数式表示)。
(2)已知热化学方程式:
H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ/mol
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是______________________________________________。
解析:(1)据图可知,反应物的总能量高于生成物的总能量,该反应是放热反应,反应热为:ΔH=-(E1-E2) kJ/mol;由于反应物的总能量低于活化分子的最低能量,因此反应需要加热。
(2)由图可知,在反应H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ/mol中,活化分子的最低能量比反应物分子的能量高167.2 kJ/mol;该反应是放热反应,反应物分子的能量又比生成物分子的能量高214.8 kJ/mol,因此活化分子的最低能量比生成物分子的能量高(241.8+167.2) kJ/mol=409 kJ/mol;逆过程是吸热反应,逆反应的活化能高于原反应的活化能,应等于原反应中活化分子的最低能量与生成物分子的能量差,即409 kJ/mol。
(3)催化剂在化学反应中起催化作用的原理是:加入催化剂,改变了反应历程,降低了反应的活化能,因此,降低反应活化能的唯一途径是使用催化剂。
答案:(1)放热 需要 -(E1-E2) kJ/mol
(2)409 kJ/mol
(3)使用了催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com