
题目列表(包括答案和解析)
2.下列变化为放热反应的是 ( )
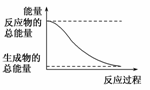
A.H2O(g)===H2O(l);ΔH=-44.0 kJ/mol
B.2HI(g)H2(g)+I2(g);ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
[答案] D
1.下列说法中正确的是 ( )
A.伴有能量变化的物质变化都是化学变化
B.放热反应在常温下一定很容易发生
C.吸热反应只有在点燃条件下才能发生
D.反应是吸热还是放热是由反应物和生成物所具有的总能量的相对大小而决定的
[答案] D
19.2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为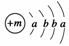 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)Z、W元素的名称为________、________。
(3)下列说法正确的是________。
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________。
A.XY2的电子式: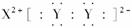
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-===2Y+Z↓
D.用电子式表示XY2的形成过程为:
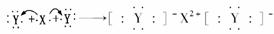
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是________________________________________________________________________。
答案:(1)20 CaCl2
(2)硫 碳 (3)B (4)B、D
(5)水分子中含有氢键
18.有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为····,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:
A________,B________,C________,D________。
(2)D元素在周期表中属第________周期________族。
(3)用电子式表示A的气态氢化物的形成过程:
_______________________________________________________________。
(4)A和B的单质充分反应生成化合物的结构式是__________________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?________________________________________________________________________。
答案:(1)碳 氧 镁 铝
(2)三 ⅢA

(4)O=C=O
(5)B与C形成的化合物是MgO,应为离子化合物;检验方法为验证其熔融物是否导电,若导电则为离子化合物,若不导电则为共价化合物
17.(2009·宿州模拟)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________________,D元素的原子结构示意图为______________________。
(2)由A、B、C三种元素形成的化合物的电子式为________________________,这种化合物中所含的化学键类型有__________。
(3)A2B的沸点高于A2D,其原因是______________________________。
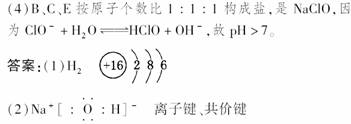
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1?1?1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是__________________________(用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总反应方程式为________________________________________________________________________。
解析:由AE分子中含18个e-,可知A为H,E为Cl。A、C同主族,B和C的最外层电子数之和与E的最外层电子数相同,则B的最外层电子数为6,为O,D为S。则C为Na。
(3)H2O中因含有氢键,其沸点高于H2S。
(3)H2O分子之间存在氢键
(4)ClO-+H2O HClO+OH-
HClO+OH-
2NaClO2NaCl+O2↑
16.(2008·辽宁凤阳三次质检)下列各组物质的晶体中,化学键类型相同、晶体类型、物质发生状态变化所克服的粒子间的相互作用也相同的是 ( )
A.SO3和HCl B.KCl和Mg
C.NaCl和H2O D.CCl4和SiO2
解析:本题考查微粒间的作用力及晶体类型。CCl4、HCl、H2O、SO3是分子晶体,发生状态变化需要克服分子间作用力,H2O还需要克服氢键;SiO2是原子晶体,发生状态变化克服共价键;NaCl、KCl是离子晶体,发生状态变化克服离子键,Mg是金属晶体,发生状态变化克服金属键。
答案:A
15.(2008·北京西城期中)判断下列有关化学基本概念的依据正确的是
( )
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
解析:离子化合物中也可能含有共价键,B错;强弱电解质的判断依据是是否完全电离,和溶液的导电能力大小没关系,C错;石墨也能够导电,但不是金属晶体,D错。
答案:A
14.(2008·天津南开质量调查)据报道,美国科学家研究发现普通盐水在无线电波的照射下可以燃烧,这很可能是21世纪人类最伟大的发现之一,未来将有望解决人类的能源危机。科学家发现无线电频率可以削弱盐水中所含元素原子之间的“结合力”,释放出H原子和O原子,一旦点火,H原子就会在这种频率下持续燃烧。上述中“结合力”实质是 ( )
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
解析:水分子中含有极性共价键,要释放出H原子和O原子,就必须破坏这种极性共价键,故B项正确。
答案:B
13.对三硫化四磷分子的结构研究表明,该分子中没有不饱和键,且各原子的最外层均已达到了8个电子的稳定结构。则一个三硫化四磷分子中含有的共价键个数是 ( )
A.7个 B.9个
C.19个 D.不能确定
解析:三硫化四磷分子式为P4S3,由题意知,各原子最外层都达8e-,且无不饱和键,则每个P原子应形成3个共价键,每个S原子应形成2个共价键,总数是=9(个)。
答案:B
12.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com