
题目列表(包括答案和解析)
1581.下列叙述中,正确的是( )
A.钠元素在自然界中,主要以化合态形式存在,其中最多的是碳酸钠
B.运用钠蒸气放电发光的性质,制造的高压钠灯能发出强烈的白炽光,其射程远,穿透力强 ,可作航船的探照灯.
C.单质钠是一种很强的还原剂,可以把钛、锆、铌、钼等金属从它们的化合物中氧化出来.
D.钠着火后,可用砂子灭火,不能用水,也不能用泡沫灭火器灭火.
23.天然气;增大;天然气不完全燃烧,产生有毒的CO;丁烷遇冷凝结为液体,使管道流通不畅。
|
|
24.CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是: 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为
(保留2位小数)。
② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。
化学反应中的能量变化补充题答案
1---5C、C、B、C、A 6---10B、C、B、D、A 11---15C、B、A、A、A
16---21A、D、D、C、D、C
22,⑴由溶解热的定义:一定温度及压力下(通常为298K和101kPa),一定量的溶质溶解于某溶剂中产生的热效应。溶质的量为1mol时为摩尔溶解热,中学把溶解热理解为摩尔溶解热。因此,可计算如下:
CuSO4·5H2O(s)=CuSO4(aq)+5H2O(l);△H
250g Q
a g Q1
所以 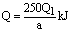 ⑵ag胆矾失水后溶于水中放出Q2kJ热量
CuSO4·5H2O-CuSO4
250g 160g
a g
⑵ag胆矾失水后溶于水中放出Q2kJ热量
CuSO4·5H2O-CuSO4
250g 160g
a g 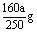 CuSO4(s)=CuSO4(ag);△H′
160g Q′
CuSO4(s)=CuSO4(ag);△H′
160g Q′
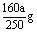 Q2
所以
Q2
所以 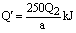 ⑶设CuSO4·5H2O分解为CuSO4和5H2O的热效应为△H。
根据⑴可知:①CuSO4·5H2O(s)= CuSO4(aq)+5H2O(l);
△H 1 =+250Q1 /a kJ·mol-1
根据⑵可知:②CuSO4(s)= CuSO4(ag);△H 2 =-250Q2/a kJ·mol-1
①-②得:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H =△H 1-△H 2
∴△H =△H 1-△H 2=
⑶设CuSO4·5H2O分解为CuSO4和5H2O的热效应为△H。
根据⑴可知:①CuSO4·5H2O(s)= CuSO4(aq)+5H2O(l);
△H 1 =+250Q1 /a kJ·mol-1
根据⑵可知:②CuSO4(s)= CuSO4(ag);△H 2 =-250Q2/a kJ·mol-1
①-②得:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H =△H 1-△H 2
∴△H =△H 1-△H 2=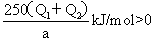 故此过程为吸热热反应。
答案:(1)250Q1/a
吸热(2)250Q2/a 放热(3)吸热 250(Q1+Q2)/a
故此过程为吸热热反应。
答案:(1)250Q1/a
吸热(2)250Q2/a 放热(3)吸热 250(Q1+Q2)/a
23.目前大部分城市居民所使用的燃料主要是管道煤气,使用天然气作为居用燃料对环境更为有利。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
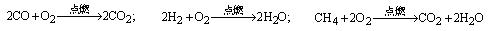 根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是_________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是_________进风口(填增大或减小),如不作改进可能产生的不良结果是_________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丁烷等,它们的某些性质见下表:
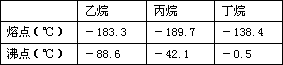
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是____________________ _ __。
22.称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。 (1)胆矾的溶解热为 kJ·mol-1,是 (填”吸热”或“放热”);
(2)无水硫酸铜的溶解热为 kJ·mol-1,是 过程。
(3)从以上数据可知,胆矾脱水是 过程,1mol胆矾脱水需 kJ·mol-1热量。
21.(2010全国课标)已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1;HCl(aq)与NaOH反应的△H=-55.6kJ·mol-1,则HCN在水溶液中电离的△H等于( )
A.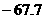 kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5
kJ·mol-1 D.+67.7
kJ·mol-1
kJ·mol-1 B.-43.5 kJ·mol-1 C.+43.5
kJ·mol-1 D.+67.7
kJ·mol-1
20.(2010重庆卷)已知H2(g)+Br2(l) 2HBr (g);△H=-72kJ·mol-1 蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
|
|
H2(g) |
Br2(g) |
HCl(g) |
|
1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404 B.260 C.230 D.200
19.(2010山东)下列与化学反应能量变化相关的叙述正确的是 ( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应热
D.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件下的△H不同
18.(2010浙江)下列热化学方程式或离子方程式中,正确的是:( )
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置 于密闭的窗口中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
 N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应:Mg + 2OH-===Mg(OH)2↓
D.氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O===2[Al(OH)4]-
17.(2010四川)节能减排对发展经济、保护环境有重要意义。下列措施不能减少二氧化碳排放的是 ( )
A.利用太阳能制氢 B.关停小火电企业
C.举行“地球一小时”熄灯活动 D.推广使用煤液化技术
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com