
题目列表(包括答案和解析)
6.在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是 ( )
A.CH3OH(l)+3/2O2(g) CO2(g)+2H2O(l) △H=+725.8 kJ/mol
B.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-1452 kJ/mol
C.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=-725.8 kJ/mol
D.2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(l) △H=+1452 kJ/mol
5.已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则下列与乙炔有关的热化学方程式正确的是 ( )
A.4CO2(g) + 2H2O(l) =2C2H2(g) + 5O2(g);ΔH = +4b kJ·mol-1
B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l);ΔH = +2b kJ·mol-1
C.2C2H2(g) + 4O2(g) =4CO2(g) + 2H2O(l);ΔH = -4b kJ·mol-1
D.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l);ΔH = +b kJ·mol1
4.下列关于反应能量的说法正确的是 ( )
A.HI(g)  1/2H2(g)+ 1/2I2(s);△H = -26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = -26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
B.H+(aq) + OH-(aq) =H2O(l);△H = -57.3kJ/mol,含1molNaOH的烧碱溶液与含0.5mol H2SO4的稀硫酸混合后放热肯定为57.3 kJ
C.Zn(s) + CuSO4(aq) = ZnSO4(aq) + Cu(s);△H = -216kJ/mol,E反应物>E生成物
D.CaCO3(s) =CaO(s) + CO2(g);△H = +178.5kJ/mol,E反应物>E生成物
3.已知由石墨制备金刚石的反应为:C(石墨) C(金刚石);△H>0;则下列两个反应中:C(石墨)+O2(g) CO2(g);△H=
-akJ·mol-1;C(金刚石)+ O2(g) CO2(g);△H=-bkJ·mol-1。则a与b的关系为 ( )
A.a>b B.a<b C.a=b D.无法确定
2.已知热化学方程式:SO2(g)+ 1/2O2(g)
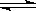 SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
SO3(g) △H= ―98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为 ( )
A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
1.热化学方程式C(s)+H2O(g) CO(g)+H2(g);△H =+131.3kJ/mol表示( )
CO(g)+H2(g);△H =+131.3kJ/mol表示( )
A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ
21.(2008·江苏高考)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有:________。(填字母)
a.减少化石燃料的使用
b.植树造林,增大植被面积
c.采用节能技术
d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2OC6H12O6+6O2
b.CO2+3H2催化剂△CH3OH+H2O
c.CO2+CH4催化剂△CH3COOH
d.2CO2+6H2催化剂△H2C===CH2+4H2O
以上反应中,最节能的是________,原子利用率最高的是________。(填字母)
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
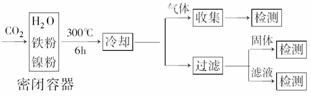
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
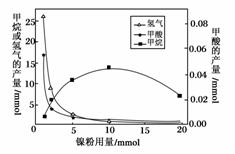
研究人员根据实验结果得出结论:HCOOH是CO2转化为CH4的中间体,即CO2HCOOHCH4
①写出产生H2的反应方程式:__________________________________________。
②由图可推知,镍粉是________。(填字母)
a.反应Ⅰ的催化剂 b.反应Ⅱ的催化剂
c.反应Ⅰ、Ⅱ的催化剂 d.不是催化剂
③当镍粉用量从1 mmol增加到10 mmol,反应速率的变化情况是________(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ、Ⅱ的速率均不变
d.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
[答案] (1)a、b、c、d (2)a c
(3)①3Fe+4H2O(g)300 ℃催化剂Fe3O4+4H2
②c ③e
0.(3)0.5 t
(4)3975 t
20.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,由乙醇制取氢气具有良好的应用前景。已知由乙醇制取氢气可有如下两条路线:
①水蒸气催化重整:
CH3CH2OH(g)+H2O(g)===4H2(g)+2CO(g);ΔH=+255.58 kJ·mol-1
②部分催化氧化:
CH3CH2OH(g)+1/2O2(g)===3H2(g)+2CO(g);ΔH=+13.76kJ·mol-1
请回答下列问题:
(1)下列说法正确的是__________。(填字母)
A.从原料消耗的角度来看,路线①制氢更有价值
B.从能量消耗的角度来看,路线①制氢更加有利
C.由于路线②制氢要消耗很多能量,故在实际生产中意义不大
D.路线①和路线②均使用催化剂,是为了降低反应所需的能量
(2)在体积为1 L的密闭容器中充入2 mol CO和4 mol H2,一定条件下发生反应:
4H2(g)+2CO(g)CH3CH2OH(g)+H2O(g);ΔH=-255.58 kJ·mol-1欲使n(CH3CH2OH)/n(CO)增大,应采取措施是__________________。(答两项即可)
(3)若用0.81 t淀粉为原料,理论上可制得质量分数为92%的乙醇溶液__________t。
(4)若用乙醇得到的合成气(CO、H2的混合气)来合成一种生物汽油。乙醇按路线①和路线②的反应各占50%,合成气合成生物汽油的反应为:
2mCO+2(2m+n)H2→2CmHn+2mH2O
假定这种生物汽油中含有X、Y两种成分,且X、Y都是含8个碳原子的烃,X是苯的同系物,Y是烷烃。1 t质量分数为92%的乙醇经上述转化(假定各步转化率均为100%),最终可得到X的质量为多少吨?
[解析] 1 t 92%的乙醇溶液中含乙醇为2.0×104 mol,按①、②反应的乙醇的量均为1.0×104 mol。
依①、②得n(CO,总)=4.0×104 mol,n(H2,总)=7.0×104 mol
依题意和原子守恒可得,生成汽油的总量为5.0×103 mol
进一步可得n(C8H10)?n(C8H18)=3∶1则C8H10的物质的量为3.75×103 mol,质量为0.3975 t
[答案] (1)AD
(2)将H2O(g)从体系中分离出来(或充入H2或降低温度或增大压强等)
19.化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体,我国南海海底有极其丰富的“可燃冰”资源。
①将“可燃冰”从海底取出,“可燃冰”融化即可放出甲烷气体。试解释其原因:__________________________________。
②取356 g分子式为CH4·9H2O的“可燃冰”,将其释放的甲烷完全燃烧生成液态水,可放出1780.6 kJ的热量,则甲烷的燃烧热为________。
(2)设计出燃料电池使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。最近科学家制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示)。电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。
①已知该电池的负极反应为C4H10+13O2--26e-===4CO2+5H2O,则该电池的正极反应为____________,电池工作时,电池中O2-向____________极移动。
②液化石油气燃料电池最大的障碍是氧化反应不完全而产生的____________(填写物质的名称)堵塞电极的气体通道。
(3)能源的紧缺在很大程度上制约了我国的经济发展。请你提出解决能源紧缺问题的两点建议________________________________________________________________________
________________________________________________________________________。
[答案] (1)①“可燃冰”固体是高压下甲烷与水形成的,从海底取出后,压强减小,而该固体本身分子间的作用力较弱,所以会融化放出甲烷气体
②890.3 kJ·mol-1
(2)①O2+4e-===2O2- 负
②固体炭
(3)寻找新能源;提高燃料的燃烧效率;提高能源利用率(任写两条即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com