
题目列表(包括答案和解析)
16.(2010全国Ⅱ)下面均是正丁烷与氧气反应的热化学方程式(25℃,101kPa):
①C4H10(g)+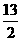 O2(g)=4CO2(g)+5H2O(l)
O2(g)=4CO2(g)+5H2O(l) 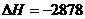 kJ/mol
kJ/mol
②C4H10(g)+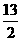 O2(g)=4CO2(g)+5H2O(g)
O2(g)=4CO2(g)+5H2O(g) 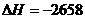 kJ/mol
kJ/mol
③C4H10(g)+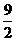 O2(g)=4CO2(g)+5H2O(l)
O2(g)=4CO2(g)+5H2O(l) 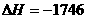 kJ/mol
kJ/mol
④C4H10(g)+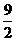 O2(g)=4CO2(g)+5H2O(g)
O2(g)=4CO2(g)+5H2O(g) 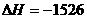 kJ/mol
kJ/mol
由此判断,正丁烷的燃烧热是 ( )
A.-2878kJ/mol B.-2658 kJ/mol C.-1746 kJ/mol D.-1526 kJ/mol
15.(2010广东)在298K、100kPa时,已知:2H2O(g) 2H2(g)+O2(g);△H1
H2(g)+Cl2(g) 2HCl(g); △H2 2H2O(g)+2Cl2(g) 4HCl(g) +O2(g);△H3
则△H3与△H1和△H2间的关系正确的是 ( )
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1- △H2
14. (2009海南)已知:Fe2O3(s)+C(s)= CO2(g)+2Fe(s)
(2009海南)已知:Fe2O3(s)+C(s)= CO2(g)+2Fe(s)
△H=234.1kJ·mol-1
C(s)+O2(g)=CO2(g)
△H=-393.5kJ·mol-1 则2Fe(s)+O2(g)=Fe2O3(s)的△H是 ( )
则2Fe(s)+O2(g)=Fe2O3(s)的△H是 ( )
A.-824.4kJ·mol-1 B.-627.6kJ·mol-1 C.-744.7kJ·mol-1 D.-169.4kJ·mol-1
13.(2008海南)白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。
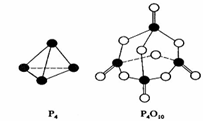 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是 ( )
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1 D.(4a+5d-4c-12b)kJ·mol-1
12.有下列五个化学方程式:
① C2H2(g) +
H2(g)  C2H4(g); ② CH4(g)
C2H4(g); ② CH4(g)  H2(g) + C2H4(g),
H2(g) + C2H4(g),
③ C(s) + 2H2(g)  CH4(g);△H=-x KJ· mol-1,
CH4(g);△H=-x KJ· mol-1,
④ C(s) + H2(g) 1/2C2H2(g);△H=-y KJ· mol-1,
1/2C2H2(g);△H=-y KJ· mol-1,
⑤ C(s) + H2(气)=1/2C2H4(g);△H=-z KJ· mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③至⑤式中x、y、z的大小顺序正确的是 ( )
A.x >y>z B.x>z>y C.y>x>z D.z>x>y
11.已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
2 Fe3O4(s)+CO2(g) = 3 Fe2O3(s)+CO(g) △H=+47kJ/mol
Fe3O4(s) +CO(g) =3FeO(s)+ CO2(g) △H=+19kJ/mol
则反应FeO(s)+ CO(g)= Fe(s)+ CO2(g) 的△H= ( )
A.-22 kJ/mol B.+11 kJ/mol C.-11 kJ/mol D.+22 kJ/mol
10.下列说法正确的是 ( )
A.测定HCI和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度
B.在101KPa时,l molH2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧热为-285.8kJ/mol
C.在101 KPa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热量,则
C的燃烧热为110.5 kJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3lKJ/mol,若将含 0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
9.强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1);ΔH =-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是 ( )
A.△H1>△H2>△H3 B.△H1<△H3<△H2 C.△H1△H2<△H3 D.△H1>△H3>△H2
8.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g) 2H2O(l) △H1= -Q1
kJ• mol-1
(2)2H2(g)+O2(g) 2H2O(l) △H1= -Q2
kJ• mol-1
(3)2H2(l)+O2(g) 2H2O(g) △H1= -Q3
kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是 ( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3 C. Q3> Q2> Q1 D. Q1=Q2=Q3
7.根据热化学方程式(在101 kPa时):S(s)+O2(g)=SO2(g)ΔH=-297.23 kJ/mol,分析下列说法中不正确的是 ( )
A.S的燃烧热为297.23 kJ/mol
B.S(g)+O2(g)=SO2(g)放出的热量大于297.23 kJ
C.S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ
D.形成1 mol SO2的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)的化学键所吸收的总能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com