
题目列表(包括答案和解析)
5.(2009·日照模拟)人体血液的正常pH约为7.35-7.45,若在外界因素作用下突然发生改变就会引起“酸中毒”或“碱中毒”,甚至有生命危险。由于人体体液的缓冲系统中存在如下平衡:
H++HCO H2CO3
H2CO3 CO2+H2O
CO2+H2O
H++PO HPO H++HPO
HPO H++HPO H2PO
H2PO
故能维持血液pH的相对稳定,以保证正常生理活动。下列说法中不合理的是 ( )
A.当强酸性物质进入人体的体液后,上述缓冲系统的平衡向右移,从而维持pH稳定
B.当强碱性物质进入人体的体液后,上述缓冲系统的平衡向左移,从而维持pH稳定
C.某病人静脉滴注生理盐水后,血液被稀释,会导致c(H+)显著减小,pH显著增大,可能会引起碱中毒
D.在人体进行呼吸活动时,如CO2进入血液,会使平衡向左移动,c(H+)增大,pH略减小
答案:C
4.(2009·安庆模拟)在相同温度下,等体积等物质的量浓度的下列4种稀溶液:①Na2S,②H2SO3,③NaHSO3,④Na2SO4中含带电微粒由多到少的顺序是 ( )
A.①④②③ B.④①③②
C.①④③② D.④①②③
解析:设4种溶液中含4种物质均为1 mol,
①Na2S===2Na++S2-,S2-+H2OHS-+OH-,故Na2S溶液中带电微粒数大于3 mol。②H2SO3H++HSO,H2SO3溶液中带电微粒数小于2 mol。③NaHSO3===Na++HSO,HSOH++SO,NaHSO3溶液中带电微粒大于2 mol,小于3 mol。④Na2SO4===2Na++SO,溶液中带电微粒数等于3 mol,故C项正确。
答案:C
3.下列电离方程式正确的是 ( )
A.NaHS溶于水:NaHS===Na++HS-,
HS-+H2O H3O++S2-
H3O++S2-
B.KH2PO4溶于水:H2PO 2H++PO
2H++PO
C.HF溶于水:HF===H++F-
D.NH4Cl溶于水:NH+2H2O NH3·H2O+H3O+
NH3·H2O+H3O+
答案:A
2.(2009·安徽江南十校模拟)(1)已知pH=2的次碘酸(HIO)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;(2)0.01 mol/L的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合,所得溶液均呈中性,则下列有关结论不正确的是 ( )
A.HIO是强酸 B.HIO3是强酸
C.HMnO4是强电解质 D.HIO是弱酸
解析:将c(H+)与c(OH-)相等的HIO和NaOH溶液等体积混合后溶液呈酸性,说明次碘酸溶液中存在未电离的HIO,故HIO为弱酸,A项错误,D项正确;0.01 mol/L的HIO3或HMnO4溶液与pH=12即c(OH-)=0.01 mol/L的Ba(OH)2溶液等体积混合后溶液呈中性,说明HIO3和HMnO4在溶液中完全电离,二者都为强酸,B、C正确。
答案:A
1.根据生活经验,判断下列物质按酸碱性的一定顺序依次排列正确的是 ( )
A.厕所清洁剂 厨房清洁剂 醋 肥皂
B.醋 厕所清洁剂 肥皂 厨房清洁剂
C.厕所清洁剂 醋 肥皂 厨房清洁剂
D.厨房清洁剂 醋 肥皂 厕所清洁剂
答案:C
23.(6分)(2009·浙江杭州高三第一次质检)在一定温度下有甲、乙两容积相等的容器。
(1)向甲容器中通入3 mol N2和4 mol H2,反应达到平衡时,生成NH3 amol。此时,NH3的物质的量分数是________。若在达到平衡状态的甲容器中通入少量的N2,则达到新平衡时,体系中N2的体积分数将________(选填“增大”、“减小”或“不变”)。
(2)向乙中通入2mol NH3,欲使反应达到平衡时,各物质的浓度与(1)中第一次平衡时相同,则起始时还需通入________mol N2和________mol H2。
(3)若起始时,向乙中通入6mol N2和8mol H2,达到平衡时,生成的NH3的物质的量为b mol,______(选填“>”、“<”或“=”)。
解析:(1)N2 + 3H2
 2NH3
2NH3
起始量 3 4 0
反应量 a a a
平衡量 3-a 4-a a
则平衡时,NH3的物质的量分数是
×100%=×100%
若平衡后,充入少量N2,平衡虽然向正反应方向移动,但平衡移动只是“减弱”这种改变,故达新平衡时,N2体积分数将增大。
(2)向乙中通入2mol NH3,相当于是1mol N2,3mol H2。要想达到与甲容器相同的平衡,还需加入N2(3-1)mol,H2(4-3)mol,即2mol N2,1mol H2。
(3)若起始时向乙中通入6mol N2和8mol H2,相当于先让2个乙容器中分别充入3mol N2和4mol H2,平衡时生成NH3共2amol,然后再压缩至一个乙容器中,则平衡向生成NH3的方向移动,平衡后生成bmol NH3,大于2amol,故<。
答案:(1)×100% 增大 (2)2 1 (3)<
|

|
22.(12分) (2009·江苏)联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)
 N2O4(g);ΔH=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2的转化率的是
N2O4(g);ΔH=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2的转化率的是
( )
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量。则反应2N2H4(l)+N2O4(l)===3N2(g)+4H2O(l)的ΔH=________kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0 mol·L-1、c(N2O4)=0.012 0 mol·L-1。计算反应2NO2(g)
 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00 L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
解析:(1)降低温度化学平衡向右移动,NO2的转化率增大;增加NO2的浓度等效于给这个密闭体系增大压强,平衡向右移动,NO2的转化率也会增大。
(2)ΔH=-19.14kJ·mol-1×2×32g·mol-1=-1 224.96kJ·mol-1。
(3)据题意可知平衡时:c(N2O4)=0.012 0 mol·L-1,c(NO2)=0.030 0 mol·L-1
K===13.3,
(4)由(3)可知平衡时n(N2O4)=c(N2O4)×V=0.012 0 mol·L-1×1.00 L=0.012 0 mol,
n(NO2)=c(NO2)×V=0.030 0 mol·L-1×1.00 L=0.030 0 mol,电子转移数目n=0.012 0 mol×2+0.030 0 mol×1=0.054 0 mol
由Cu-2e-可知m(Cu)=×64 g·mol-1=1.73 g。
答案:(1)B、C (2)-1 224.96 (3)K=13.3 (4)1.73 g
21.(9分)(2009·山东省英雄山中学第一学期期末检测)在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:

A、B、C、D、E、F的起始加入量分别为2mol、1mol、0mol、Xmol、Ymol、Zmol,两边反应达平衡后,隔板恰好在正中间位置。
(1)恒温时,若向左边容器中充入0.3molHe,则右边容器内的平衡向________移动(填“左”、“右”或“不”)。
(2)恒温时,若向左边容器中通入的不是He,而是2molA和1molB的气体,与原平衡相比,C的体积分数________(填“增大”、“减小”或“不变”,下同)右边容器中气体平均相对分子质量________。
(3)恒温时,在(2)题的平衡体系中,若向左右两容器中同时再各注入1molHe,平衡后与(2)题的原平衡体系相比,下列说法正确的是________(填序号)。
A.C、F的浓度都不变
B.B的转化率、F的分解率均增加
C.A、D物质的量都增加了
D.A、B、C、D、E、F物质的量都不变
答案:(1)右 (2)增大 增大 (3)B
20.(7分)在一固定体积的密闭容器中,在850°C时发生如下反应:
CO(g)+H2O(g)
 CO2(g)+H2(g);ΔH=-41.2 kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850°C时其化学平衡常数K=1.0)。
CO2(g)+H2(g);ΔH=-41.2 kJ/mol。容器内各物质的浓度(mol/L)变化如下(在850°C时其化学平衡常数K=1.0)。
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是__________________。
A.容器内压强不变
B.v正(H2)=v逆(CO)
C.混合气体中CO2的浓度不变
D.c(CO2)=c(CO)
(2)若在850°时向反应容器中充入H2O(g),K值________(填“增大”、“减小”或“不变”,下同);若升高反应体系的温度,K值________。
(3)上表中:c1=________mol/L,H2O(g)的转化率为________。
答案:(1)BC (2)不变 减小 (3)0.08 0.4或40%
19.(12分)(2009·山东省枣庄市高三第一学期期末测试)某可逆反应的反应过程中能量变化如下图所示,回答下列问题。
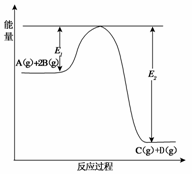
(1)若E1=215kJ·mol-1,E2=625kJ·mol-1,则该反应的热化学方程式为________________________________________________________________________。
(2)当反应达到平衡时,降低温度,A的转化率________(填“增大”“减小”或“不变”),原因是__________________________。
(3)该反应的平衡常数表达式为K=________,升高温度平衡常数K________(填“增大”、“减小”、“不变”或“可能增大,也可能减小”)。
(4)在反应体系中加入催化剂,反应速率增大,则________(用字母代号填空)。
A.E1减小,E2减小,反应热不变
B.E1减小,E2减小,反应热减小
C.E1减小,E2增大,反应热减小
D.E1增大,E2增大,反应热增大
答案:(1)A(g)+2B(g)
 C(g)+D(g)
C(g)+D(g)
ΔH=-410kJ·mol-1
(2)增大 降低温度,平衡向放热反应方向(即正反应方向)移动,A的转化率增大
(3)[C][D]/[A][ B]2 减小
(4)A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com