
题目列表(包括答案和解析)
10.常温下,有pH为12的NaOH溶液100 mL,若将其pH变为11(设溶液的体积可直接相加,计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_____________mL。
(2)若用pH=2的盐酸,应加入___________mL。
解析:(1)设加入NaOH溶液的体积为V1,则
10-2 mol·L-1×0.1 L+10-4 mol·L-1×10-3V1=10-3 mol·L-1×(0.1 L+10-3V1)
解得V1=1000 mL
(2)设加入盐酸的体积为V2,则
10-2 mol·L-1×0.1 L-10-2 mol·L-1×10-3 V2=10-3 mol·L-1×(0.1 L+10-3V2)
解得V2=81.8 mL
答案:(1)1000
(2)81.8
9.有甲、乙两份等体积的浓度均为0.1 mol·L-1,pH=11的氨水。
(1)甲用蒸馏水稀释100倍,则NH3·H2O的电离平衡向___________(填“左”或“右”)移动,溶液的pH将为___________(填序号)。
A.9-11之间 B.11
C.12-13之间 D.13
(2)乙用0.1 mol·L-1的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液比较,pH_____________(填“甲大”“乙大”或“相等”),其原因是______________________________。
解析:稀释能导致电离平衡正向移动,若将pH=11的强碱稀释100倍,则稀释后pH为9,而NH3·H2O为弱碱,所以溶液pH介于9-11之间。
答案:(1)右 A (2)甲大 乙中加NH4Cl后c( )增大,抑制NH3·H2O的电离
)增大,抑制NH3·H2O的电离
8.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A.pH=2的盐酸溶液和pH=12的氢氧化钠溶液
B.pH=2的盐酸溶液和pH=12的氢氧化钡溶液
C.pH=2的醋酸溶液和pH=12的氢氧化钠溶液
D.pH=2的盐酸溶液和pH=12的氨水溶液
解析:四个选项中pH(酸)+pH(碱)均等于14。A、B是强酸与强碱溶液等体积混合,混合液pH=7;C中醋酸为弱酸,反应后有剩余,混合液pH<7;D中碱为弱碱,反应后有剩余,混合液pH>7。
答案:D
7.相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积( )
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
解析:等体积、等pH的醋酸和盐酸,若稀释相同倍数,由于醋酸中存在电离平衡,稀释时正移,使H+数目增加,故pH将小于盐酸,若使之与盐酸相同,再需继续加水稀释,所得体积大于盐酸。
答案:B
6.pH=13的强碱溶液与pH=2的强酸溶液混合,pH=11,则强碱与强酸的体积比为( )
A.11∶1 B.9∶1 C.1∶1 D.1∶9
解析:混合液pH=11,碱过量,设强碱、强酸体积分别为V1、V2则:
10-3=
解之V1∶V2=1∶9。
答案:D
5.(2010辽宁高考综合,28)向醋酸溶液中滴加NaOH溶液,则( )
A.醋酸的电离平衡向左移动 B.溶液的pH减小
C.醋酸根离子的物质的量减小 D.醋酸的浓度减小
解析:醋酸溶液中存在着下列平衡CH3COOH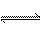 CH3COO-+H+,当向其中滴加NaOH时,由于H++OH-====H2O使平衡向右移动,溶液的pH增大,醋酸根离子浓度增大,醋酸浓度减小。
CH3COO-+H+,当向其中滴加NaOH时,由于H++OH-====H2O使平衡向右移动,溶液的pH增大,醋酸根离子浓度增大,醋酸浓度减小。
答案:D
4.下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( )
A.两种溶液中OH-浓度相同 B.需要等浓度、等体积的盐酸中和
C.温度升高10 ℃,两溶液的pH仍相等 D.两种溶液中溶质的物质的量浓度相同
解析:pH相同,则c(OH-)相同;由于NH3·H2O中存在电离平衡,NH3·H2O没有全部电离,所以两溶液中溶质物质的量浓度不等,中和时所需HCl不等;温度升高,促进NH3·H2O的电离,c(OH-)增大,pH增大,而NaOH中不存在电离平衡,c(OH-)不变,pH不变。
答案:A
3.下列溶液一定呈中性的是( )
A.pH=7的溶液 B.由强酸、强碱等物质的量反应得到的溶液
C.非电解质溶于水得到的溶液 D.c(H+)=c(OH-)的溶液
解析:溶液呈中性的根本标志是c(H+)=c(OH-)。当pH=7时,只说明c(H+)=10-7 mol·L-1。当温度升高时,中性溶液中的c(H+)>10-7mol·L-1,即pH<7,故A错误。等物质的量的强酸与强碱,由于它们所含的H+和OH-的物质的量未知,因此无法判断混合后溶液的酸碱性。若n(H+)>n(OH-),H+过量,溶液呈酸性;若n(H+)<n(OH-),OH-过量,溶液呈碱性;只有当n(H+)=n(OH-)时,H+和OH-恰好完全反应,溶液才呈中性。故C也错误。非电解质只是它本身不能直接电离产生离子,当它溶于水时可能与水反应生成能电离的物质,使溶液呈酸性或碱性,如SO2溶于水生成H2SO3,溶液呈酸性;NH3溶于水生成氨水,溶液呈碱性。
答案:D
2.(2010全国高考理综Ⅱ,10)相同体积的pH=3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是( )
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
解析:本题通过Mg与pH相等的强酸、弱酸的反应推断产生H2的多少,主要考查考生对弱酸的浓度及pH的含义的理解,侧重考查分析判断能力。相同pH的强酸和弱酸所对应酸的浓度不同,相同pH的弱酸的浓度大于强酸的浓度,同体积的弱酸的物质的量多,因此与足量镁反应产生的H2多。
答案:A
1.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
解析:因醋酸为弱电解质,pH同为2时,醋酸的物质的量浓度大于盐酸,中和等量的氢氧化钠时,消耗醋酸的体积要比盐酸少,所以B、C、D错,A正确。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com