
题目列表(包括答案和解析)
7.下列说法不正确的是
A.纯碱溶液清洗油污,加热可增强其去污能力
B.船身镶上锌块能减轻海水对船身的腐蚀,这是利用了原电池原理
C.医疗上血液透析是利用了胶体的丁达尔效应
D.甲烷燃烧放热,表明反应物的总能量大于生成物的总能量
6.下列叙述错误的是
A.将石油催化裂化的目的是获取乙烯、丙烯、甲烷等重要的化工原料
B.分子式为C4H10O且属于醇类的同分异构体共有4种
C.物质CH2=CHCOOH可以发生氧化、加成和酯化反应
D.可以利用溴水来鉴别苯与液态的油脂
29. 甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
甲、乙、丙、戊都具有如图所示的结构或结构单元,图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同。已知:
甲、乙是同一类晶体中的各自结构单元,单质甲能与乙发生置换反应,丙、丁、戊三种粒子含有等量的电子数,其中丙、丁是同一类晶体中的分子或分子集团,常温下丁呈液态,能产生两种等电子数的粒子,戊是阳离子。
(1)写出液态丁产生两种等电子粒子的电离方程式: 。
(2)室温下含有戊的盐溶液,其pH(填编号) 。
A.>7 B.=7 C.<7 D.以上都有可能
(3)丙是目前重要的能源
① 丙和丁在催化、加热条件下得到两种可燃性的气体,其反应的化学方程式是
。
② 现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况
下,其负极反应的电极方程式为 。
(4)甲、乙高温反应时,甲被破坏了1 mol共价键,则参加反应的乙为 g。
13. 恒温、恒压下,1 mol A和n mol B在一个容积可变的容器中发生如下反应:
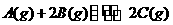 ,一段时间后达到平衡,生成
,一段时间后达到平衡,生成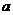 mol C。则下列说法中正确的是
mol C。则下列说法中正确的是
A. 物质A、B的转化率之比为1:2
B. 起始时刻和达平衡后容器中的压强比为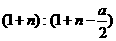
C. 若起始时放入3mol A和3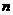 mol B,则达平衡时生成3
mol B,则达平衡时生成3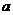 mol C
mol C
D. 当 时,可断定反应达到平衡
时,可断定反应达到平衡
*26. Ⅰ.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下。

请根据题目要求回答下列问题。
(1)A的化学式为 ,上述操作过程中用到的玻璃仪器有:①烧杯 、 ②玻璃棒、③酒精灯、④ ;
(2)趁热过滤的目是 。
Ⅱ.硫酸亚铁晶体(相对分子质量278)受热易分解。某课外小组设计如图的实验装置来检验其分解产物。
(1)该装置中最不合理的部分(填字母)_____,原因是_______________ 。
(2)改用正确装置,实验开始后,B中硫酸铜变蓝, C中有白色沉淀,最终A处固体变为红棕色。
①.D中的实验现象是________________,反应的离子方程式为______________。
②.写出硫酸亚铁晶体加热分解反应的化学方程式 。
③.若要检验A处生成的红棕色固体,最好选用的试剂是 和 (用名称填空)
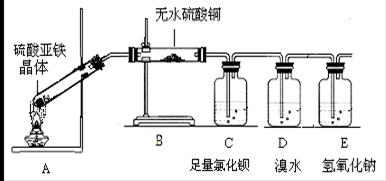
 27.甲、乙、丙是三种常见的物质,其中甲是银白色固体,丙是黑色固体。Y是密度最小的物质,X的水溶液跟胃酸的主要成分相同。向F溶液中滴加几滴KSCN试剂,溶液呈红色。各物质的转化关系如下图:
27.甲、乙、丙是三种常见的物质,其中甲是银白色固体,丙是黑色固体。Y是密度最小的物质,X的水溶液跟胃酸的主要成分相同。向F溶液中滴加几滴KSCN试剂,溶液呈红色。各物质的转化关系如下图:
(1)写出X的电子式: 写出乙的化学式
(2)Y和Z的混合物叫 ,写出丙+E→Y+Z的化学方程式:
(3)写出乙+浓X溶液→C+D+E的离子方程式:
|
|
|

写出丁和丙反应的化学方程式:
*28. 芳香族化合物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,B的一元硝化产物有三种。有关物质之间的转化关系如下:
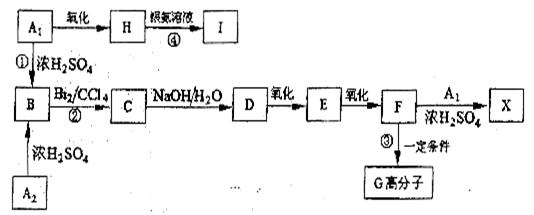
(1)反应②属于 反应,反应④属于 反应。(填反应类型)
(2)写出下列两种物质的结构简式:
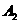 X
X
(3)写出下列反应的化学方程式:
③
④
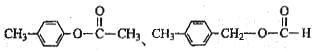 (4)化合物E有多种同分异构体,其中属于酯类且苯环上有两个对位取代基的同分异构体有四种,除外,
(4)化合物E有多种同分异构体,其中属于酯类且苯环上有两个对位取代基的同分异构体有四种,除外,
其余两种是: 、
12. 利用下列装置(部分仪器已省略),能顺利完成对应实验的是
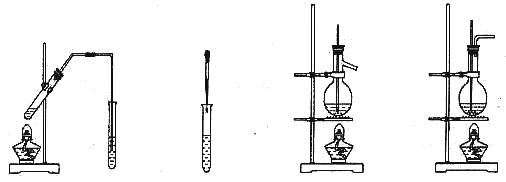
A. 制乙酸乙酯 B. 制氢氧化亚铁C. 石油的分馏 D. 实验室制乙烯
11. 用盐酸、氨水和苛性钠溶液中的任何一种试剂,均可鉴别的一组物质是
A. NaCl和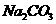 两种晶体 B.
两种晶体 B. 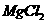 和
和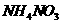 两种溶液
两种溶液
C. 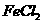 和
和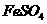 两种溶液 D.
两种溶液 D. 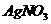 和
和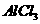 两种溶液
两种溶液
9. 已知甲乙两种化合物都只含X、Y 两种元素,在甲中X元素的质量分数大于乙中的X元素的质量分数,若甲的化学式为XY2,则乙的化学式可能为 ( )
A.XY B.X2Y5 C.X2Y3 D.X2Y
|
A.2种 B.3种 C.4种 D.8种
8. .将aL NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为bL(气体体积均在同温同压下测定),该bL气体中NH3的体积分数是
A. 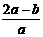 B.
B.
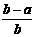 C.
C. 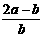 D.
D.
6.下列除杂质和分离提纯的实验操作中,错误的是
A.除去蛋白质溶液中混有的少量食盐:渗析
B.除去CO2中混有的少量SO2,将气体通过盛有足量Na2CO3溶液的洗气瓶
C.除去乙醇中混有的少量水:在乙醇中加入新制的生石灰,加热蒸馏
D.除去乙酸乙酯中混有的少量乙醇,加入饱和碳酸钠溶液振荡静置分层后分液
*7.有关键能数据如表:
|
化学键 |
Si-O |
O=O |
Si-Si |
|
键能/kJ·mol-1 |
X |
498.8 |
176 |
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)==SiO2(s)中,△H= -989.2 kJ·mol-1,则X的值为
A. 423.3 B. 920 C. 1165.2 D. 460
11.已知下列变化过程中,有0.2 mol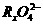 参加反应,转移0.4 mol电子。
参加反应,转移0.4 mol电子。
 --
-- RO2+
RO2+ Mn2++H2O
Mn2++H2O
(1)推算出x值为__________;
(2)配平该离子方程式______________________;
(3)反应中还原剂为___________________;
(4)在上述变化过程中,参加反应的H+的物质的量为_________mol。
解析:
(1)设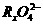 中元素R的化合价为y,由题意可知:
中元素R的化合价为y,由题意可知:
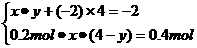
解得x=2,y=+3。
(2)用化合价升降法配平如下:
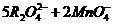 +H+--RO2+
+H+--RO2+
↑(1×2)×5 ↓5×2
Mn2++H2O
用观察法结合电荷守恒配平其他物质的化学计量数,结果为5、2、16--10、2、8。
(3) 在反应中R元素化合价由+3升高到+4,作还原剂。
在反应中R元素化合价由+3升高到+4,作还原剂。
(4)由(2)中离子方程式可知,有16
mol H+参加反应时,转移电子的物质的量为10 mol,故转移0.4 mol电子时,参加反应的H+的物质的量为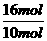 ×0.4 mol=0.64 mol。
×0.4 mol=0.64 mol。
答案:(1)2
(2)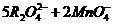 +16H+====10RO2+2Mn2++8H2O
+16H+====10RO2+2Mn2++8H2O
(3) (4)0.64
(4)0.64
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com