
题目列表(包括答案和解析)
1.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是( )
A.使用催化剂,使氮气和氢气的混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的反应
C.500 ℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
解析:使用催化剂能同等程度地加快v(正)、v(逆),而平衡不发生移动,A项不合题意;合成氨的反应是气体体积缩小的反应,增大压强,平衡向正反应方向移动,B项符合题意;合成氨的反应是吸热反应,则低温才有利于平衡正向移动,实际生产中一般采用提高温度(500 ℃),是为了加快反应速率,且500 ℃时催化剂活性最大,故C项不符合题意;合成氨采用循环操作,并没有涉及化学平衡的移动,故D项也不符合题意。
答案:B
10.有FeCl2、CuCl2混合液400 mL,经测定其中Cl-浓度是a mol·L-1,投入过量锌粉b g,充分反应后过滤,所得固体残渣洗涤干燥后,质量为c g。
(1)原混合液中,Fe2+、Cu2+的物质的量浓度。
c(Fe2+)=___________,c(Cu2+)=___________。
(2)b的数值应大于___________a g,其计算式为_____________________。
(3)c的数值越大,说明混合液中,CuCl2含量_______________;c的最大值(以a、b表示)应为________________________。
解析:设FeCl2物质的量浓度为x,CuCl2物质的量浓度为y。
由FeCl2+Zn====Fe+ZnCl2 Δm减
65 56 9
CuCl2+Zn====Cu+ZnCl2 Δm减
65 64 1
可知: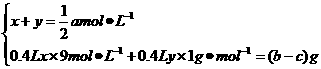 解得
解得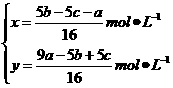
因为Zn过量,故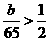 ×0.4a,即b>13a。
×0.4a,即b>13a。
利用极限值考虑法,当溶液都是CuCl2时,残渣质量最大为b-0.2a,故c<b-0.2a,即c=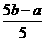 。
。
答案:(1)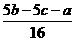 mol·L-1
mol·L-1 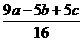 mol·L-1
mol·L-1
(2)13 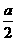 ×0.4×65=13a (3)越大
×0.4×65=13a (3)越大 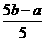
9.(2005全国高考理综Ⅲ,26)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1∶1和1∶2。高温煅烧A、B时,产物都是C(固体)和D(气体),由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入氢氧化钠溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是_________________________________________。
(2)B煅烧生成C和D的化学方程式是________________________________。
甲元素的单质与F溶液反应的离子方程式是________________________________________。
(3)往G溶液中加入NaOH溶液发生的现象是?_____________________________________。
解析:此题为综合性较强的推断题,我们可从向F溶液中加入NaOH溶液有红褐色沉淀生成推出F溶液中有Fe3+,又知该沉淀灼烧后转变为C,则C为Fe2O3;E和另一种酸组成的混合物跟甲苯反应可生成三硝基甲苯,则知E为H2SO4或HNO3,再根据前面A、B都是由甲、乙两种元素组成的,且甲、乙两种元素的原子个数比为1∶1和1∶2,知E为H2SO4,A为FeS,B为FeS2;向F溶液中加入甲元素单质得溶液G,则G为FeSO4。由此题目便可迎刃而解。
答案:(1)FeS (2)4FeS2+11O2 2Fe2O3+8SO2 2Fe3++Fe====3Fe2+
2Fe2O3+8SO2 2Fe3++Fe====3Fe2+
(3)生成的沉淀由白色变为灰绿色最终变为红褐色
8.建筑用的红砖和青砖,其颜色是由其中含有的不同价态铁的氧化物所致。我国古代砖瓦建筑能够保持到现在的,几乎无一例外的是由青砖建成。有人提出以下可能的原因:①青砖中含的是FeO;②青砖中含的是Fe3O4;③Fe2O3长期遇酸雨侵蚀会风化溶解使砖瓦强度降低;④Fe3O4性质稳定;⑤FeO性质稳定。你认为有道理的是( )
A.①③⑤ B.②③④ C.③⑤ D.①②③④⑤
解析:红砖中一般含有Fe2O3,青砖一般含有Fe3O4。Fe3O4性质稳定,所以我国由青砖建成的古代建筑能够保持到现在。
答案:B
7.某同学设计下列方法对A盐的水溶液进行鉴定:
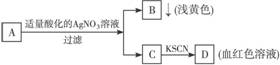
由此得出的以下结论中,不正确的是( )
A.D溶液中存在[Fe(SCN)]2+ B.滤液中有Fe3+
C.B为AgBr浅黄色沉淀 D.A一定为无氧酸盐FeBr2
解析:根据B、D现象可确定A是由Fe3+和Br-或由Fe2+和Br-组成的盐。
答案:D
6.Cu+在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。若检验用氢气还原CuO所得的红色产物中是否含有Cu2O,应选用的试剂是( )
A.浓硝酸 B.稀硝酸 C.浓硫酸 D.稀硫酸
解析:由题给信息知:Cu2O在酸性条件下可生成Cu和Cu2+,A、B、C三个选项的酸均有强氧化性,能与铜反应都有蓝色溶液生成;只有加入稀硫酸时,若产物Cu中含有Cu2O时,会有蓝色溶液生成,若全部为Cu则无明显现象。
答案:D
5.在硫酸铁溶液中加入a g铜,完全溶解后,再加入b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是( )
A.残余固体全部是铜 B.残余固体可能为铁和铜的混合物
C.残余固体是铁,溶液中一定不含Cu2+ D.最后得到的溶液中可能含Fe3+
解析:残留固体中一定含有Cu,由于a>c,说明溶液中一定含有Cu2+,故c g残余固体中不可能含有Fe,溶液中也一定不含Fe3+。
答案:A
4.铜粉放入稀硫酸中,加热后无明显现象发生;当加入一种盐后,铜粉的质量减少,溶液呈蓝色。该盐可能是( )
①AgNO3 ②Na2CO3 ③KNO3 ?④FeSO4⑤FeCl3
A.①③⑤ B.①②④ C.①④⑤ D.②③⑤
解析:因为铜与稀硫酸不反应,故无明显现象发生,加入一种盐后,铜粉溶解,溶液由无色变为蓝色,说明该盐具有强氧化性或在稀硫酸中表现强氧化性,如AgNO3、KNO3在稀硫酸中形成硝酸溶液,能与铜反应,将铜粉溶解。加入FeCl3后Fe3+也能与铜粉反应使铜粉溶解。
答案:A
3.将下列四种铁的化合物溶于稀盐酸,滴加硫氰化钾溶液没有颜色变化,再加入氯水即呈红色的是( )
A.FeS B.Fe2O3 C.FeCl3 D.Fe3O4
解析:由题意可知,A中的Fe2+与SCN-结合没有颜色改变,但通入Cl2后发生下列反应,生成Fe3+,溶液变为红色。2Fe2++Cl2====2Fe3++2Cl-,Fe3++SCN-====[Fe(SCN)]2+。
答案:A
2.将铜粉与铁粉组成的混合物投入到稀硝酸中充分反应后,滤出不溶物,将此不溶物又投入到盐酸中,未见H2逸出,下列说法正确的是( )
A.滤液中一定有Fe2+ B.滤液中一定有Fe3+
C.滤液中一定有Fe2+、Cu2+ D.滤液中一定有Fe2+、Fe3+、Cu2+
解析:由题意知,铜、铁混合物与稀硝酸反应后仍有剩余,又因不溶物与盐酸不反应,故剩余物一定为Cu粉,则溶液中一定无Fe3+。而溶液中是否有Cu2+取决于还原性强的Fe能否将稀硝酸完全还原掉。故选A。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com