
题目列表(包括答案和解析)
2. 现代建设中的铝合金门窗框架,其成分可能是( )
A. Al-Ag合金
B. Al-Cu-Mg-Si合金
C. Al-Pb合金
D. 表面镀铜的铝
1. 下列说法正确的是( )
A. 所有不锈钢都只含有金属元素
B. 我国流通的硬币材质是金属单质
C. 广东正在打捞的明代沉船上存在大量铝制餐具
D. 镁合金的硬度和强度均高于钝镁
18. (2009年银川调研)合成氨工业生产中所用的α?Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为 。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为 (用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2Fe2O3+C高温4FeO+CO2↑。
为制得这种活性最高的催化剂,应向480 g Fe2O3粉末中加入炭粉的质量为 g。
第三节 用途广泛的金属材料
17. (2008年山东青岛模拟)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是
。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
16. (化学鲁科必修1 P59,3题)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式: 。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:

A. 请写出上述实验中加入或生成的有关物质的化学式:
① ,② ,③ ,④ ,
⑤ ,⑥ 。
B. 请写出相关反应的化学方程式: 。
15. (2009年高考江苏卷)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
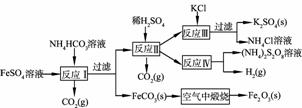
(1)反应Ⅰ前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A. 锌粉B. 铁屑C. KI溶液D. H2
(2)反应Ⅰ需控制反应温度低于35 ℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
14. (2009年高考北京卷·理综)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ从废液中提纯并结晶出FeSO4·7H2O
Ⅱ将FeSO4·7H2O配制成溶液
ⅢFeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液
Ⅳ将浊液过滤,用90 ℃热水洗涤沉淀,干燥后得到FeCO3固体
Ⅴ煅烧FeCO3,得到Fe2O3固体
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成FeCO3的离子方程式是 。
若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验SO2-4来判断沉淀是否洗涤干净,检验SO2-4的操作是 。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2高温2Fe2O3+4CO2,现煅烧464.0 kg的FeCO3,得到316.8 kg产品,若产品中杂质只有FeO,则该产品中Fe2O3的质量是 kg。(摩尔质量/g·mol-1; FeCO3:116 Fe2O3:160 FeO:72)
13. 由铁和氧化铁组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4∶1。则反应物中Fe2O3、Fe、H2SO4的物质的量之比为 。
12. 取14.4 g草酸亚铁(FeC2O4),隔绝空气加热分解,结果得到7.2 g铁的氧化物,此氧化物应是( )
A. Fe2O3
B. FeO
C. Fe3O4
D. FeO·Fe3O4
11. (2009年山东临沂模拟)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如图所示,则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为()
A. 1∶1∶1B. 1∶3∶1
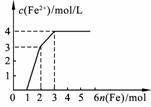
C. 3∶3∶8D. 1∶1∶4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com