
题目列表(包括答案和解析)
3.温度为T℃,压强为1.01×106Pa条件下,某密闭容器下列反应达到化学平衡A(g)+ B(g) 3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
3C(?),测得此时c(A)=0.022 mol·L-1;压缩容器使压强增大到2.02×106Pa,第二次达到平衡时,测得c(A)=0.05 mol·L-1;若继续压缩容器,使压强增大到4.04×107Pa,第三次达到平衡时,测得c(A)=0.75 mol·L-1;则下列关于C物质状态的推测正确的是
A.C为非气态 B.C为气态
C.第二次达到平衡时C为非气态 D.第三次达到平衡时C为非气态
答案 D
命题意图:考察学生对化学平衡的实质的理解,对等效平衡的应用。
思路点拨:以第一次的平衡为参照,然后在改变压强的条件下,假设平衡还没有移动,则c(A)=0.044 mol·L-1,而实际上c(A)=0.05 mol·L-1说明平衡逆向移动了,说明此时C为气态,由此同样可以判断第三次改变压强平衡正向移动了,只能是在4.04×107Pa压强下C转变为非气态。
2.能正确表示下列反应的离子方程式是 ( )
A.甲酸钠溶液和盐酸反应:HCOO-+H+ HCOOH
B.硫化钠的第一步水解:S2-+2H2O H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO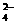
BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3- CaCO3↓+H2O
答案A
命题意图:考察了盐的水解离子方程式的书写,以及盐的水解实质。
思路点拨:B答案盐的水解特点是可逆的,多元弱酸的酸根离子的水解是分步进行的,应写成:S2-+H2O
⇋ HS-+ OH-; C答案未注意醋酸是弱酸,硫酸中的H+也参予了反应,应写成:2CH3COO-+Ba2++2H++SO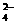
BaSO4↓+2CH3COOH; D答案是没有注意Mg(OH)2
的难溶性,应生成Mg(OH)2 和CaCO3
的沉淀,应写成:2Ca2++4OH-+Mg2++2HCO3- CaCO3↓+2H2O
+Mg(OH)2↓
1. 制H2O2过程中,先用电解NH4HSO4(以昂贵的铂作电极)得到过二硫酸。
 阴极:2H3O++2e-→H2↑+2H2O
阴极:2H3O++2e-→H2↑+2H2O
然后过二硫酸水解,最后可以制得H2O2。第一步水解 H2S2O8+H2O-→H2SO4+H2SO5 第二步水解 H2SO5+H2O-→H2SO4+H2O2,则要制得1mol H2O2,电解时转移电子数为( )
A.0.5mol B.1mol C.1.5mol D.2mol
答案 D
命题意图:考察学生对电解池的掌握,充分理解在电池中的氧化还原的实质即得失电子守恒。
思路点拨:由条件可知,H2S2O8~2e-~ H2SO5~ H2O2 由这个关系式可知D正确
10.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是_____________________________。
(2)肼-空气燃料电池是一种碱性燃烧电池,电解质是20%-30%的KOH溶液。写出肼-空气燃料电池放电时正、负极的电极反应式。
正极:_______________,负极:____________________。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是__________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气_____L(假设空气中氧气体积含量为20%)。
(4)传统制备肼的方法是,是以NaClO氧化NH3制得肼的稀溶液。该反应的离子方程式是___________________________________。

|
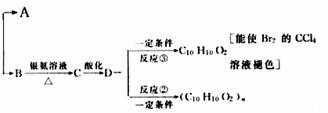
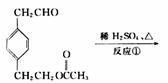
填写下列空白:
(1)B的结论简式为:____________________________。
(2)反应③的反应类型为:___________________________。
(3)A 有多种同分异构体,写出其中一种能发生银镜反应的同分异构体的结构简式____
_______________________。
(4)写出反应②的化学方程式____________________________________。
(5)B与银氨溶液反应生成C的实验中,试管内壁没有得到光亮如镜的物质,而是得到黑色沉淀,可能原因是_________________________________________________________
_________________________________________________________________________。
9.某校化学兴趣小组的同学在进行研究性学习时,对“NO2能否支持燃烧”这个问题很感兴趣,他们决定自己动手设计实验进行探究。
(1)甲组同学设计的实验方案:向烧瓶中加入适量浓硝酸并加热,当烧瓶中有红棕色气体产生后,将燃着的木条伸入烧羡慕中,发现木条熄灭。由此他们得出“NO2不能支持燃烧”的结论。
甲组同学所得的结论一定正确吗?请你说明理由:_________________________________
_________________________________________________________________________。
(2)乙组同学通过查阅资料得知,一些不活泼金属的硝酸盐受热时也能产生NO2气体,如:2Cu(NO3)2?2CuO↑+4NO2↑+ O2↑,2AgNO3?2Ag+2NO2↑+ O2↑。他们根据此原理设计了如下图所示的实验装置(加热、夹持仪器未画出),并分别用Cu(NO3)2和AgNO3进行实验,实验中发现当红棕色气体进入集气瓶中,带火星的木炭均能复燃,乙组同学由此得出“NO2能支持燃烧”的结论。
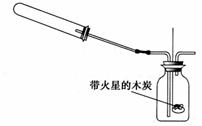
①老师认为上述两个实验中,有一个实验所得结论是不可靠的,你认为该实验中选用的反应物是_______,其结论不可靠的原因是__________________________________。
②运用该实验装置实验时,造成的不良后果是________________________________。
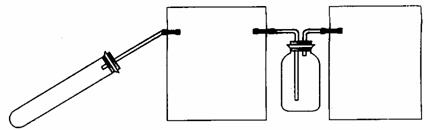
(3)丙组同学拟设计一个用较为纯净的NO2气体(无O2)来探究“NO2能否支持燃烧”的实验。
①丙组同学制取NO2的化学反应方程式是__________________________________。
②下图是该组同学设计的制取并收集较纯净的NO2气体的实验装置,请在方框中将该装置补充完整,并注明补充装置中所用试剂。
8.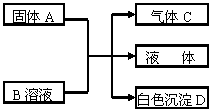 已知A、B、C、D均为中学化学的常见物质,它们之间的反应关系如下图所示:
已知A、B、C、D均为中学化学的常见物质,它们之间的反应关系如下图所示:
(1)若A是短周期主族元素中原子半径最大的元素构成的单质,D既可溶于盐酸又可溶于NaOH溶液。图示中的离子方程式为___________________________。
(2)若C是一种四原子分子,分子中四个原子在一条直线上;A与B的溶液反应只生成气体C、CaCO3和H2O,则C的电子式为____________,B的化学式为____________。
(3)若C是元素M的气态氢化物,且C能与M的最高价氧化物的水化物反应生成盐E;B是一种正盐,与E含有相同的阳离了;D不溶于稀硝酸。则A的化学式为______,B的溶液中各离子浓度由大到小的顺序为__________________。
7.在常温下,将a1 mol b1 mol·L-1的CH3COOH溶液加入到a2 mol b2 mol·L-1的NaOH溶液中。下列结论正确的是
A.如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+)
B.如果混合溶液的pH=7,则混合溶液中c(CH3COO-)>c(Na+)
C.如果混合溶液的pH<7,则a1b1=a2b2
D.如果a1=a2,且混合溶液的pH<7,则b1>b2
6.在一固定体积的密闭容器中,充入2mol
A和1mol B,发生如下反应:2A(g)+B(g)?xC(g),平衡后,C的体积分数为ω%,若维持容器容积和温度不变,以0.6mol A、0.3mol B和1.4mol
C为起始物质,达到平衡后,C的体积分数也为ω%。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数ω%、混合气体平均相对分子质量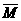 和正反应速率v正随压强P的变化,一定符合的是
和正反应速率v正随压强P的变化,一定符合的是
|
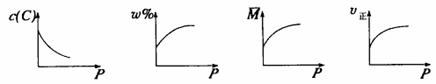
5.往100mL pH=0的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
A.0.02mol B.0.08ml C.0.10mol D.0.16mol
4.下列在指定溶液中的各组离子中能够大量共存的是
A.无色溶液中:HCO3-、Na+、Cl-、OH-
B.pH=11的溶液中:S2-、K+、CO32-、Cl-
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3-
D.水电离的c(H+)=10-12mol·L-1的溶液中,Fe3+、SO42-、SCN-、K+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com