
题目列表(包括答案和解析)
12.喀麦隆的“杀人湖”(尼奥斯湖)曾于1986年使1800名附近居民在一夜之间神秘死去。后经科学家考察发现,湖底有个火山口,积聚了大量二氧化硫等有毒气体,并发现在200 m深的湖底每立方米湖水中竟溶解了8 m3的有毒气体。目前科技人员已找到一种有效的办法将湖中有毒气体抽出加以处理。
为了测定从湖底取出的水样中SO2的含量,可在一定量的水样中加入过量的碘,再用已知浓度的硫代硫酸钠溶液滴定过量的碘,该反应为:2Na2S2O3+I2====2NaI+Na2S4O6
完成下列问题:
(1)碘和水样中SO2反应的化学方程式为(提示:该反应中I2作氧化剂,SO2作还原剂) ____________________________________。
(2)用硫代硫酸钠滴定过量的碘时,可选用______________作指示剂,当溶液_____________(填现象)便达到滴定终点。
(3)若在20 mL水样中加入碘W g,用去V mL c mol·L-1的Na2S2O3溶液,则水样中SO2的物质的量浓度是多少?
解析:(1)SO2与碘水发生氧化还原反应,生成H2SO4和HI。
(2)检验碘单质,一般考虑用淀粉溶液来检验。
(3)与SO2反应剩余的n(I2):
2Na2S2O3 - I2
2 mol 1 mol
V×10-3 L·c mol·L-1n(I2)
n(I2)=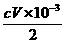 mol
mol
与SO2反应的n(I2)=(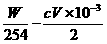 ) mol
) mol
SO2 - I2
1 mol 1 mol
n(SO2)
(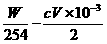 ) mol
) mol
n(SO2)=( 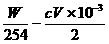 ) mol
) mol
c(SO2)=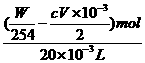
=( ) mol·L-1
) mol·L-1
答案:(1)I2+SO2+2H2O====H2SO4+2HI
(2)淀粉试液 由蓝色变为无色
(3)( ) mol·L-1
) mol·L-1
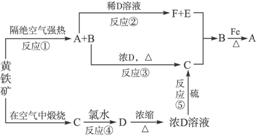
10.下图是以黄铁矿为起始反应物的一系列变化,其中不含硫的反应物和产物均已略去。
(1)写出下列物质的化学式:
A_______________________________________,E____________________________________。
(2)写出下列反应的化学方程式:
反应①__________________________________________。
反应⑤__________________________________________。
(3)写出下列反应的离子方程式:
反应②__________________________________________。
反应④__________________________________________。
解析:无机框图题是考查元素化合物知识的最主要题型,复习中应熟练掌握各物质的性质及相互转化关系,解题时抓住物质的特殊反应、特征现象,系统分析得出答案。根据框图下半部分很容易确定C为SO2,D为H2SO4;但对于FeS2隔绝空气强热的产物是不熟悉的,结合B+H2SO4(浓) SO2,SO2+E
SO2,SO2+E B,B+Fe
B,B+Fe A,可知A为FeS,B为S,E为H2S,F为FeSO4。
A,可知A为FeS,B为S,E为H2S,F为FeSO4。
答案:(1)FeS H2S
(2)FeS2 FeS+S
FeS+S
S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
(3)FeS+2H+====Fe2++H2S↑
SO2+Cl2+2H2O====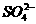 +2Cl-+4H+
+2Cl-+4H+
9.(1)用过量的锌与浓H2SO4反应,某同学认为除了生成二氧化硫外,还有氢气产生,理由是_____________________________________________________________________________。
(2)用过量铜片与0.2 mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1 mol,理由是____________________________________;
而乙同学认为产生的SO2为0.1 mol,理由是________________________________________。
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的。铜屑在此状态下被溶解的化学方程式为______________________________________。利用铜制备CuSO4的另一种方法可用化学方程式表示为___________________________。以上两种方法___________(填“前”“后”)者好,原因是_________________________。
解析:浓硫酸与金属反应时,随着反应的进行,硫酸的量不断减少,硫酸由浓变稀,稀硫酸可与锌反应产生氢气,稀硫酸不再与铜反应。
在稀H2SO4存在的条件下,Cu与O2在加热条件下反应生成碱性氧化物CuO,迅速溶解在热的稀硫酸溶液中生成CuSO4。
答案:(1)由于Zn过量,随着反应的进行,浓H2SO4变稀,稀H2SO4可与Zn反应产生H2
(2)由反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O知,当0.2 mol H2SO4全部反应时才生成0.1 mol SO2,随着反应进行,浓H2SO4变稀,而稀H2SO4与铜不反应 由于加热时间足够长,水比硫酸易挥发,因此,硫酸始终保持较高浓度,直至与铜完全反应为止
CuSO4+SO2↑+2H2O知,当0.2 mol H2SO4全部反应时才生成0.1 mol SO2,随着反应进行,浓H2SO4变稀,而稀H2SO4与铜不反应 由于加热时间足够长,水比硫酸易挥发,因此,硫酸始终保持较高浓度,直至与铜完全反应为止
(3)2Cu+2H2SO4(稀)+O2 2CuSO4+2H2O
2CuSO4+2H2O
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
前 若制得1 mol CuSO4,第一种方法只需1 mol H2SO4,而第二种方法则要用2 mol H2SO4,而且生成的SO2会造成大气污染
8.在二氧化碳中混有少量的二氧化硫、三氧化硫、氯化氢杂质。设计一种一步只除去一种杂质,最后得到干燥纯净二氧化碳的实验方案。试完成下列问题:
(1)气体经过各试剂(自选)的顺序为_______________________。
(2)写出有关的离子方程式:________________________________________________ 。
解析:首先确定除各种杂质应采用的试剂。①除去SO3可选用浓硫酸使它溶解,这样可以不影响CO2、SO2和HCl。②除去SO2的试剂在CO2为主气体时,不能用NaOH,可用KMnO4酸性溶液,但HCl也溶于KMnO4酸性溶液中,甚至HCl会被氧化生成Cl2(带入新的杂质)。若选用NaHCO3,虽能除SO2,但同时也除去了HCl,所以也不能选用。但若在除SO3之后除去HCl,可选用NaHSO3饱和溶液,可不影响CO2、SO2。然后再用饱和NaHCO3除SO2即可。气体用溶液洗气后必然混有水蒸气,可用干燥剂除之。
答案:(1)浓硫酸→饱和NaHSO3→饱和NaHCO3→浓硫酸(或无水氯化钙等酸性或中性干燥剂)
(2)H++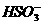 ====SO2↑+H2O
====SO2↑+H2O
SO2+2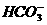 ====
====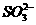 +2CO2+H2O
+2CO2+H2O
7.(2010上海高考,8)浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如图6-3。分析a、b曲线变化的原因是( )
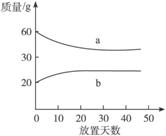
图6-3
A.a升华、b冷凝 B.a挥发、b吸水
C.a蒸发、b潮解 D.a冷凝、b吸水
解析:本题考查学生对浓、稀硫酸的吸水与其中水分挥发的差异。在两种溶液中都存在吸水与水分的挥发两个过程,只不过在浓H2SO4中以吸收水分为主,溶液质量增加;而2 mol·L-1的稀H2SO4中以水分挥发为主,质量减小。故本题答案为B。
答案:B
6.(2010广东广州联考)将SO2通入BaCl2溶液至饱和,未见沉淀,继续通入另一种气体X仍未沉淀,则X可能是( )
A.CO2 B.NH3
C.Cl2 D.NO2
解析:B:NH3+SO2+H2O====2 +
+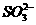 ;
;
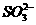 +Ba2+====BaSO3↓;
+Ba2+====BaSO3↓;
C:Cl2有氧化性,Cl2+SO2+2H2O====4H++2Cl-+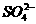 ,
,
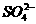 +Ba2+====BaSO4↓;
+Ba2+====BaSO4↓;
D:NO2具有氧化性,将SO2氧化为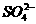 ,而生成BaSO4↓。
,而生成BaSO4↓。
答案:A
5.下列四种溶液中,一定存在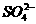 的是( )
的是( )
A.向甲溶液中加入BaCl2溶液,产生白色沉淀
B.向乙溶液中加入BaCl2溶液,有白色沉淀,再加入盐酸,常常不溶解
C.向丙溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生
D.向丁溶液中加入硝酸酸化,再加入硝酸钡溶液,有白色沉淀产生
解析:本题为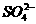 鉴定题,鉴定
鉴定题,鉴定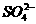 存在要排除干扰离子,例如
存在要排除干扰离子,例如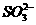 、
、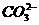 、
、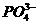 、Ag+等,这样才能准确把握确定
、Ag+等,这样才能准确把握确定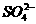 的存在。
的存在。
甲溶液中可能存在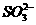 、
、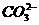 、
、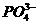 或Ag+;乙溶液中可能存在Ag+;丁溶液中用硝酸酸化,若溶液中存在
或Ag+;乙溶液中可能存在Ag+;丁溶液中用硝酸酸化,若溶液中存在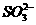 ,会被氧化成
,会被氧化成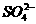 ,故答案为C。
,故答案为C。
答案:C
4.将浓硫酸慢慢滴入浓盐酸中,产生的现象是( )
A.放出黄绿色气体 B.冒白雾,混合物温度升高
C.液体四溅,冒白烟 D.冒白雾,温度降低
解析:浓盐酸具有强挥发性,产生的HCl在空气中形成白雾。浓盐酸中滴入浓硫酸时,因浓硫酸具有吸水性而使盐酸浓度增加,同时浓硫酸吸水放热,混合物的温度升高。
答案:B
3.(2010广东中山质检)足量的浓H2SO4与m g铜完全反应,得到的SO2气体的体积为n L(20 ℃、1.01×105 Pa),则被还原的硫酸是( )
A.m/64 mol B.64n/22.4 mol
C.98n/22.4 g D.64n/22.4 g
解析:根据化学方程式Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O计算,被还原的硫酸可用铜的量来表示,其值为m/64 mol,也可用生成的二氧化硫的量来表示,但考虑到产生的气体体积不是在标准状况下测定的,因此不能选C。
CuSO4+SO2↑+2H2O计算,被还原的硫酸可用铜的量来表示,其值为m/64 mol,也可用生成的二氧化硫的量来表示,但考虑到产生的气体体积不是在标准状况下测定的,因此不能选C。
答案:A
2.下面描述二氧化硫的一些化学性质中,二氧化硫作还原剂的是( )
A.溶于水生成不稳定的H2SO3 B.与H2S气体混合出现淡黄色固体
C.通入品红溶液中,品红溶液褪色 D.能使溴水褪色
解析:二氧化硫溶于水生成不稳定的H2SO3,是酸性氧化物的通性,二氧化硫是亚硫酸的酸酐;与H2S气体混合出现淡黄色固体,二氧化硫表现氧化性;二氧化硫使品红溶液褪色,表现漂白性;二氧化硫通入溴水中,可被溴水氧化为硫酸,二氧化硫表现还原性。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com