
题目列表(包括答案和解析)
22.(2009·泰州模拟)随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
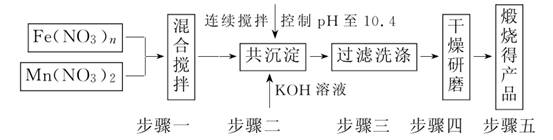
(1)原料Fe(NO3)n中n=____________,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比应为__________。
(2)步骤二中“连续搅拌”的目的是____________;步骤三中洗涤干净的标准是______________________。
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4>1 000 KMnFe2O4-x+O2↑
MnFe2O4-x+xH2O―→MnFe2O4+xH2↑
请认真分析上述两个反应并回答下列问题:
①若MnFe2O4-x中x=0.8,则MnFe2O4-x中Fe2+占全部铁元素的百分率为__________。
②该热化学循环制氢的优点有(答两点即可)__________________________________________________。
③该热化学循环法制氢尚有不足之处,进一步改进的研究方向是______________________________。
解析:(1)Mn为+2价,则MnFe2O4中Fe的化合价为+3价,则Fe(NO3)n中n=3,且二者比例为2∶1。
(2)连续搅拌是为了让二者充分反应,洗涤至中性保证产物纯净。
(3)①x=0.8时,铁的总价态为(4-0.8)×2-2=4.4,设1 mol MnFe2O4-0.8中含Fe2+、Fe3+物质的量分别为x mol、y mol,则有:
解得:x=1.6,y=0.4,则1 mol MnFe2O4-0.8中含Fe2+的物质的量为1.6 mol,则Fe2+占的百分率为×100%=80%。
②③由流程可看出其优点,改进方法可从流程简洁方面考虑。
答案:(1)3 2∶1 (2)充分反应、沉淀完全 洗涤至流出液呈中性 (3)①80%
②过程简单、节约能量、无污染、物料廉价并可循环使用及氧气和氢气在不同步骤生成,不存在高温气体分离的问题等(答两点即可)
③寻找合适的催化剂,使MnFe2O4分解温度降低或分解温度更低的氧化物(其他合理答案亦可)
21.(2009·常州模拟)水是地球上最重要的一种物质,试回答下列问题:
Ⅰ.饮用水的安全事关人民的健康,在饮用水的处理过程中,经常要用到消毒剂,其中以“84”消毒液、漂白粉等较为常见。除了上述消毒剂以外,ClO2由于处理水时不产生致癌的有机氯化物,因此已经逐渐地取代氯气等成为饮用水处理中常用的消毒剂。
(1)漂白粉的商品名又叫漂白精,其中包装袋上注明保存时要密封,启用后需要立即使用,切忌长时间放置,请用化学方程式表示其原因:______________________________________。
(2)生产ClO2常用的方法是在酸性条件下还原NaClO3,例如:
①2ClO+4H++2Cl-===2ClO2↑+Cl2↑+2H2O
②2ClO+SO+2H+===2ClO2↑+SO+H2O
比较两种方法,你认为__________比较好,优点是________________________________________________。
Ⅱ.海水中含有大量的宝贵资源,工业上从海洋中制溴的方法是:先把盐卤(海水中氯化钠被分离后剩下的母液)加热到363 K后控制pH为3.5,通入氧气把溴置换出来,再用一种气体X把溴吹出并用碳酸钠溶液吸收,这时溴就歧化生成溴离子和溴酸根离子,最后用硫酸酸化,单质溴就从溶液中析出。根据上述信息回答下列问题:
(1)把溴吹出的气体X,工业上最适宜选用________。
A.NH3 B.空气 C.氩气 D.CO2
(2)用Na2CO3溶液吸收溴,再用硫酸酸化,析出溴,是工业上获取溴的方法之一。用离子方程式表示该反应过程:
①____________________________________;
②____________________________________。
解析:Ⅰ.(1)漂白粉的主要成分是Ca(ClO)2和CaCl2,Ca(ClO)2在空气中易吸收CO2和H2O而发生如下反应:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO光2HCl+O2↑,所以漂白粉在空气中会变质,漂白粉应密封且放在干燥处保存。
(2)判断方法优劣,应从以下几个方面分析:反应物的用量、反应的条件、产物的多少以及对环境有无污染等,所以②比较好,不产生Cl2,无污染,消耗酸量小。
Ⅱ.(1)NH3易溶于水,氩气是稀有气体,CO2易造成温室效应,从经济上、环境上考虑最适宜的是空气。
(2)离子方程式为:
3CO+3Br2===5Br-+BrO+3CO2↑,
5Br-+BrO+6H+===3Br2+3H2O。
答案:Ⅰ.(1)Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO光2HCl+O2↑
(2)② 不产生Cl2,无污染,消耗酸量小
Ⅱ.(1)B
(2)①3CO+3Br2===5Br-+BrO+3CO2↑
②5Br-+BrO+6H+===3Br2+3H2O
20.某研究性学习小组对铝热反应实验进行研究,“铝热反应”的现象是“反应放出大量的热,并发出耀眼的光芒”和“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》可知,Al、Fe2O3、Al2O3、Fe的熔、沸点数据如下:
|
物质 |
Al |
Fe2O3 |
Al2O3 |
Fe |
|
熔点(℃) |
660 |
1
462 |
2
054 |
1
535 |
|
沸点(℃) |
2
467 |
- |
2
980 |
2
750 |
(1)某同学推测,铝热反应所得到的熔融物质是铁铝合金。理由是:该反应放热,能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?__________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。填写下列表格:
|
所用试剂 |
|
|
实验操作及现象 |
|
|
有关反应的化学方程式 |
|
(3)实验室欲溶解此熔融物,下列试剂中最好的是__________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.NaOH溶液
答案:(1)合理
(2)
|
所用试剂 |
氢氧化钠溶液 |
|
实验操作及现象 |
取适量块状熔融物置于试管中,加入氢氧化钠溶液,有气体产生 |
|
有关反应的化学方程式 |
2Al+2NaOH+2H2O===2NaAlO2+3H2↑ |
(3)B
19.如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油。
资料一:石蜡是含有20-30个碳原子的烷烃的混合物,常温下呈固态。
资料二:石油催化裂化中通常使用Al2O3做催化剂。
某研究性学习小组在实验室中模拟石油的催化裂化。装置如图:实验过程中可观察到烧杯Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液褪色,实验后闻试管Ⅱ中液体气味,具有汽油的气味。
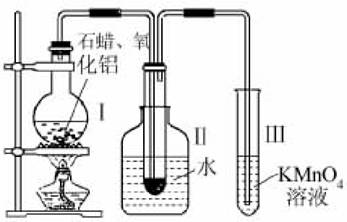
(1)该装置仪器连接的顺序应遵循的原则为__________,为保证实验成功,实验前必须进行的操作是__________,装置中较长导管的作用是______________________________;
(2)试管Ⅱ中少量液体凝结说明了__________;
(3)试管Ⅲ中溶液褪色说明了__________;
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,理由是______________________________________。
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式__________________________________。
(6)石油裂化的重要意义是________________________________。
答案:(1)从下往上,从左往右 检验装置的气密性 导气、冷凝气体
(2)裂化生成了5个碳原子数以上的烃
(3)裂化生成了碳原子数小于5的烯烃
(4)不能,因为裂化产物中有烯烃,易与溴发生加成反应
(5)C20H42Al2O3△C10H22+C10H20
(6)可提高石油产品中轻质燃油特别是汽油的产量和质量
18.若将海水淡化做饮用水使用时,下列方法在原理上完全不可行的是( )
A.加明矾使海水中的盐分沉淀而淡化
B.利用太阳能使海水蒸馏淡化
C.将海水缓慢凝固以获取淡化的饮用水
D.将海水通过离子交换树脂,以除去所含离子
解析:明矾净水是利用Al3+水解生成的Al(OH)3胶体的吸附作用而除去水中的一些悬浮物,并不能除去海水中的阴、阳离子而使海水淡化。利用太阳能使海水蒸馏淡化,是有研究价值的一种淡化途径。海水缓慢凝固后可结成冰,在这个过程中可以除去海水中的离子而淡化。将海水通过离子交换树脂使海水淡化是一种已被应用的海水淡化方法。
答案:A
第Ⅱ卷(非选择题,共46分)
17.以下人体日常补水的观点中,你认为科学的是( )
A.长期饮用碳酸饮料有利于人体补充CO2
B.因为自来水都用氯气、漂白粉或二氧化氯消毒过,所以可直接饮用
C.最好喝纯净水,因为纯净水不含任何化学物质
D.运动员大量运动出了很多汗,最好喝含有氯化钠的水,这样可以补充必需的盐分
解析:A项,人体不需要补充CO2;B项,消毒过的水中含有氯,需经过处理后再饮用;C项纯净水中至少含有水这种化学物质。
答案:D
16.下列叙述能改善空气质量的是( )
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能等能源替代化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
解析:以煤等燃料作为生活燃料会产生大量空气污染物;私人汽车代替公交车会使汽油消耗量增加,带来的空气污染物增多。
答案:B
15.成分不同的石油,加工方法往往不同。下列有关石油的加工方法,说法不正确的是( )
A.为了获得更多的轻质燃油,往往需要对石油进行分馏处理
B.为了提高汽油的产量,通常采用裂化,裂化分为热裂化、加氢裂化和催化裂化三种
C.为了提高汽油的品质,往往对汽油进行催化重整
D.催化重整可以使汽油中烷烃的支链增加,环烷烃和烷烃转变为芳香烃,从而提高汽油品质
解析:对石油的加工处理,常见的方法有分馏、裂化和重整。石油的分馏是利用沸点的不同,对各种成分进行分离的方法,A错误;裂化是为了提高轻质燃油特别是汽油的产量的方法,裂化可分为热裂化、催化裂化和加氢裂化三种方式,故B正确;催化重整可以提高汽油的品质,可以调整分馏所得到的汽油中烃分子的碳链结构,使其中的烷烃支链增加,环烷烃转变为芳香烃,所以C、D正确。
答案:A
14.氯、溴、碘等卤族元素主要来自海水,很多海洋植物中都含有大量的碘,反应①是从海藻灰中提取碘的主要反应,反应②是从智利硝石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4===2NaHSO4+MnSO4+2H2O+I2;
②2NaIO3+5NaHSO3===2Na2SO4+3NaHSO4+H2O+I2。
下列有关说法正确的是( )
A.NaI和NaIO3在一定条件下能反应生成I2
B.I2在反应①中是还原产物,在反应②中是氧化产物
C.两个反应中生成等量的I2时转移电子数相等
D.氧化性:MnO2>IO>I2>SO>Mn2+
解析:由NaI得到I2,碘元素化合价升高,I2是氧化产物,由NaIO3得到I2,碘元素化合价降低,I2是还原产物,B项错误;在反应①中,得到1 mol I2需要转移2 mol电子,而在反应②中得到1 mol I2需要转移10 mol电子,故C错误;由两个反应可以判定D选项也是错误的。
答案:A
13.从海水中提取镁,需要在海水中加碱[Mg2++2OH-===Mg(OH)2↓],沉淀经分离后转化为氯化镁[Mg(OH)2+2H+===Mg2++2H2O],最后电解得到金属镁[MgCl2(熔融)通电Mg+Cl2↑],下列说法中正确的是( )
A.电解氯化镁的过程是氧化还原反应
B.将沉淀转化为氯化镁的过程,是镁原子失电子转化为Mg2+的过程
C.电解得到金属镁的过程能写出离子方程式,但不是氧化还原反应
D.Mg在CO2中燃烧的反应可以改写为离子方程式
解析:MgCl2(熔融)通电Mg+Cl2↑,此过程中存在着化合价的变化,因此A正确而C错误;将沉淀转化为氯化镁的过程,是氢氧化镁转化为Mg2+的过程,而不是原子和离子间的转化,故B错误;Mg在CO2中燃烧的反应不能写出离子方程式。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com