
题目列表(包括答案和解析)
3.常温下把铁片投入到下列溶液中,铁片溶解,溶液质量增加,但是没有气体产生的是( )
A.硫酸铁溶液
B.浓HNO3
C.盐酸
D.硫酸锌溶液
2.在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是( )
①FeCl3与Cu反应 ②FeCl3与H2S反应 ③FeCl3与KI反应 ④FeCl3滴入沸水中 ⑤FeCl3与NaHCO3反应 ⑥FeCl3溶液中滴入石蕊试液
A.③④⑤⑥
B.③④⑤
C.④⑤⑥
D.②③⑤
1.(2010年潍坊测试)南极考察队在印度洋发现了一种不寻常的鱼,它的血液像水一样无色透明。研究发现这种鱼的血液中某种元素的含量是其他鱼血液中的十分之一。这种元素是( )
A.Cu
B.Ag[C.Fe
D.Pb
29. (共10分)
(共10分)
(1) (1分)
 (2分)
(2分)
(2)氢氧化钠水溶液 ;(1分)浓硫酸,加热 。(1分)

(3) (2分)
(4) ②⑥⑦ (填编号)(3分)。
附加题
(1) (2)三角锥形(1分);[Ag(NH3)2]+(1分),配位(2分)
28.(12分)(1)2ClCH2COO--2e-=ClCH2CH2Cl+2CO2↑(2分)
(2)分液(2分)  (2分)
(2分)
(3)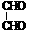 +4Ag(NH3)2OH
+4Ag(NH3)2OH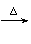

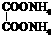 +6NH3+4Ag↓+2H2O
(2分)
+6NH3+4Ag↓+2H2O
(2分)
(4)① (2分)
② HO
(2分)
② HO H(2分)
H(2分)
27.(12分)⑴AD ⑵400 40% ⑶ > < ⑷2 n(D)>0.6mol
26. (9分)⑴VIA ⑵S
(9分)⑴VIA ⑵S
⑶
⑷< NH4++H2O NH3·H2O+H+
镁粉逐渐溶解,且有气泡产生
NH3·H2O+H+
镁粉逐渐溶解,且有气泡产生
⑸金属质量(或质量) W元素(或N元素或原子)
29. 惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:


试回答下列问题:
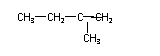
(1)A的结构简式为 ;F的结构简式为 。
(2)反应②中另加的试剂是 ;反应⑤的一般条件是 。
(3)反应③的化学方程式为 。
(4)上述合成路线中属于取代反应的是 (填编号)。
附加题:下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
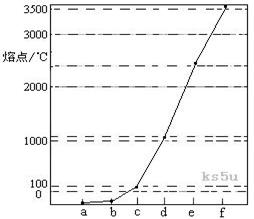
(1)a代表 元素单质 ,b代表 元素单质, c代表 元素单质, d代表 元素单质 e代表 元素单质 f代表 元素单质
(2)a与b的元素形成的10电子中性分子X的空间构型为 ;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为 ,其中X与Ag+之间以 键结合。
化学知识点考察检测(1)
BDDA DCBD
11.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
 x Mg+Mo3S4 Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是
x Mg+Mo3S4 Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是
A.Mg2+向正极移动 B.正极反应为:Mo3S4+2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg - 2xe- = xMg2+
*12.“人文奥运、科技奥运、绿色奥运”是2008年北京奥运会的重要特征。其中禁止运动员使用兴奋剂是重要举措之一。以下两种兴奋剂的结构分别为:


①利尿酸 ②兴奋剂X
则关于它们的说法中正确的是
 A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
A.利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰
B.1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2
C.两种兴奋剂均属于芳香烃化合物
D.两种分子中的所有碳原子均不可能共平面
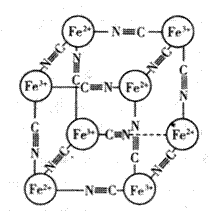 *13.分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)Z ],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点, 自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
*13.分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)Z ],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点, 自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
A.该晶体属于原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为60%(体心中没有M+的占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
*26. W、X、Y、Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻。已知W元素的氢化物与Z元素的氢化物反应只生成一种盐a;X、Y位于同一族,它们能组成YX2、YX3两种常见化合物。请回答下列问题:
⑴X元素位于周期表中第 族(用字母表示);
⑵X、Y、Z三种元素形成的单质中,氧化性最弱的是 (填化学式);
⑶Y与Z可形成共价化合物Y2Z2,分子中Y与Z均满足8电子稳定结构,则Y2Z2的电子式为 ;
⑷a溶液的pH (填“>”、“<”或“=”)7,用离子方程式解释
。若在a溶液中加入少量镁粉,可观察到的现象是: ;
⑸取pH=0的W的最高价氧化物对应水化物的溶液100.0mL于某容器中,加入0.90g Cu、Ag合金样品,充分反应后测得生成WO(其中O表示氧元素)气体的体积为156.8mL(标准状况下),反应后容器中溶液的c(H+)=0.72mol·L-1(假设反应后溶液体积不变)。
若设Cu、Ag的物质的量分别为x、y。欲求x、y的值,可列出下列计算式:
Ⅰ. 64x+108y=0.90该计算式是依据 关系列出的;
*Ⅱ. 2x+y=1mol·L-1×0.1L- (0.72mol·L-1×0.1L+0.1568L/22.4L·mol-1) 该计算式依据的是 守恒。
 *27. 如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变,发生反应:A(g)+3B(g)
*27. 如图,有甲、乙两容器,甲体积可变压强不变,乙保持体积不变。向两容器中分别充入1molA、3molB,此时两容器体积均为500mL,温度为T℃。保持温度不变,发生反应:A(g)+3B(g) 2C(g)+D(s);△H<0。
2C(g)+D(s);△H<0。
 ⑴下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是
⑴下列选项中,能表明甲和乙容器中反应一定达到平衡状态的是
A.混合气体的总质量不随时间改变; B.2v正(C)=3v逆(B);
C.A、B转化率相等; D. 物质D的质量不随时间改变;
⑵2min后甲容器中反应达到平衡,测得C的浓度为2mol/L,此时容器的体积为
mL,B的转化率α甲(B)为 .
⑶乙容器中反应达到平衡所需要的时间 2min(填“>”、“<”或“=”),B的转化率α乙(B) α甲(B)。(填“>”、“<”或“=”)
⑷其它条件不变,甲中如果从逆反应方向开始反应建立平衡,要求平衡时C的物质的量与⑵中平衡时C的物质的量相等,则需要加入C的物质的量n(C)= mol,加入D的物质的量n (D)应该满足的条件为 。
*28. 将羧酸的碱金属盐溶液用惰性电极电解可得到烃类化合物,例如:
2CH3COOK+2H2O
 CH3CH3↑+2CO2↑+H2↑+2KOH
CH3CH3↑+2CO2↑+H2↑+2KOH
现有下列衍变关系(A、B、C、D、E、F、G均为有机物):

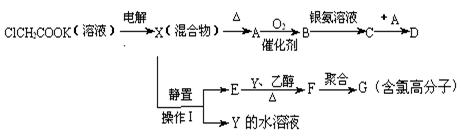
回答下列问题:
(1)写出电解ClCH2COOK溶液时的阳极的电极反应式_____________________。
(2)操作Ⅰ的名称是_____________,G的结构简式是_________________。
(3)写出B与银氨溶液按物质的量1:4反应生成C的化学方程式________________。
(4)A和C在不同条件下反应,会生成不同的D。
①若D的相对分子质量是B的2倍,则D的结构简式是_____________________;
②若D是高分子化合物,则D的结构简式是____________________。
10.分别燃烧下列各组物质中的两种有机化合物,所得CO2和H2O的物质的量之比相同的是
A.乙烯、乙炔 B.乙醇、乙醚(C2H5-O-C2H5)
C.甲苯、乙苯 D.乙酸、丁醛
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com