
题目列表(包括答案和解析)
5. 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数小于10),如下图,则下列判断错误的是( )
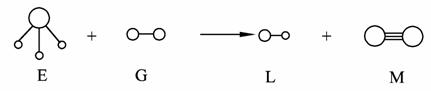
A. G是最活泼的非金属单质
B. L中的化学键是极性键
C. E能使紫色的石蕊试液变蓝
D. M的化学性质活泼
4. (2008年高考海南卷·化学)HBr分子的电子式为( )
A. 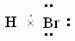
B. H+Br-
C.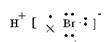
D. H-Br
3. (2007年高考广东卷·理基)下列物质中含离子键的是( )
A. Cl2 B. CO2
C. NaCl D. CH4
2. 固体乙醇晶体中不存在的作用力是( )
A. 离子键 B. 极性键
C. 非极性键 D. 范德华力
1. (2008年高考上海卷·化学)化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. CO2的电子式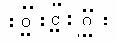
B. Cl-的结构示意图 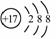
C. 乙烯的结构简式C2H4
D. 质量数为37的氯原子1737Cl
17. W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因: 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式: 。
第三节 化学键
16. (2009年长春实验中学模拟)现有A、B、C、D四种短周期元素,已知A、B同主族,B、C、D同周期,A、B的原子序数之和等于C、D的原子序数之和,C的单质能分别跟B和D的最高价氧化物的水化物反应。请回答:
(1)B和C的元素符号分别为 。
(2)上述四种元素的原子半径由大到小的顺序(用元素符号表示)为 。
(3)D单质在A单质中燃烧的产物与二氧化碳反应的离子方程式为 。
(4)由A、B形成的化合物是一种大气污染物,可用足量D的最高价氧化物的水化物来除去,写出反应的离子方程式: 。
15. (2009年高考天津卷·理综)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④⑤⑥的原子半径由大到小的顺序为 。
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是 。
(3)①④⑤⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为 (填序号)。
a. MnO2 b. FeCl3 c. Na2SO3 d. KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X Z A N ⑥的单质







 Y
Y
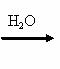 M(仅含非金属元素的盐)
M(仅含非金属元素的盐)
X溶液与Y溶液反应的离子方程式为 ,N→⑥的单质的化学方程式为 。
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。
14. A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
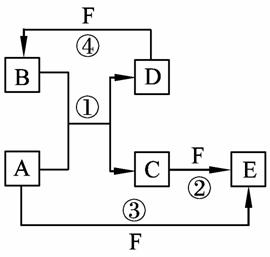
(1)若A为短周期金属单质,D为短周期非金属单质,且元素的原子序数A是D的2倍,原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 ,反应④的化学方程式为 。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是 。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 。
13. (2008年山东淄博模拟)Ⅰ. 如图所示,虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表。请在虚线框中用实线画出周期表第1至第6周期的轮廓,并画出金属与非金属的分界线。

Ⅱ. X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X、Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)在上面所绘制的草表中,将X、Y、Z、M、N五种元素的元素符号填写在相应位置。
(2)请写出下列反应的离子方程式:
N单质与NaOH溶液反应: 。
(3)Y与Z相比,非金属性较强的元素是 ,可以证明该结论的实验是(用离子方程式表示)
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com