
题目列表(包括答案和解析)
15. 有4种化合物W(通常状况下是气态)、X(通常状况下是液态)、Y、Z(通常状况下是固态),它们共由5种短周期元素A、B、C、D、E组成。已知:①原子序数为A<B<C<D<E,且A与D同族;C与E同族;B与C同周期。②W由A和B组成,且W分子中,A与B的原子个数比为4∶1;X由A和C组成,且X分子中A与C的原子个数比为1∶1;Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1∶1。③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2∶1。试推断写出
(1)W的化学式是 ,W属于 化合物。
(2)X的电子式是 ,X属于 化合物,并设计简单的实验证明:
。
(3)1 mol Y在干燥的空气中质量会 (填“增大”或“减小”),其变化量(Δm)为 。
(4)用电子式表示化合物Z的形成过程 。
14. 有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为  ,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:
A. ,B. ,C. ,D. 。
(2)D元素在周期表中属第 周期第 族。
(3)用电子式表示A的气态氢化物的形成过程: 。
(4)A和B的单质充分反应生成化合物的结构式是 。
(5)四种元素中,的最高价氧化物的水化物既能溶于酸,又能溶于碱,其溶于NaOH溶液的化学方程式为 。
13. 已知短周期元素A、B、C、D、E、F及其化合物G、P、Q、M、T、K、X、Y,请根据下列信息回答问题。
①常温下,F的单质是一种有色气体,常用于杀菌、消毒;
②A的单质可以溶于NaOH溶液,向生成的溶液中通入CO2气体有白色沉淀生成,该沉淀可溶于过量盐酸中;
③C的氢化物分子G具有10电子,可以发生下列转化


 G D的单质 P D的单质Q H2O M+P
G D的单质 P D的单质Q H2O M+P
④E和D是同一主族的元素,两者能形成粒子的个数比1∶2和1∶3的化合物T和K;
⑤B和D可形成粒子个数比为1∶1和2∶1的离子化合物X和Y。
请回答下列问题:
(1)B元素的名称是 ;
(2)E元素的原子结构示意图是 ;
(3)请将A、C的元素符号填在下图所示部分元素周期表的适当位置上。

(4)G的电子式为 。化合物X所含化学键类型有 ;
(5)①T与F的单质的水溶液反应的离子方程式为 ;
②G与D的单质反应的化学方程式为 ;
③M的稀溶液与铜反应的化学方程式为 。
12. 已知氢化锂(LiH)属于离子化合物。LiH跟水反应可以放出氢气。下列叙述中正确的是( )
A. LiH的水溶液显中性
B. LiH中的氢离子可以被还原生成氢气
C. LiH是一种强氧化剂
D. LiH中氢离子比锂离子的半径大
11. 下列性质中,可以证明某化合物内一定存在离子键的是( )
A. 水溶液能导电
B. 由金属和非金属元素的原子组成
C. 熔融状态能导电
D. 可以溶于水
10. 人类在地球上生活而不能脱离地球,是因为地球对人类有吸引力。同样,原子之间能自动结合主要是因为它们之间存在着强烈的相互作用--化学键,化学键使得100多种元素构成了多姿多彩的世界。下列关于化学键的说法中,不正确的是( )
A. 离子化合物可能含有共价键,共价化合物中不含离子键
B. 构成单质分子的微粒一定含有共价键
C. 由非金属元素组成的化合物不一定是共价化合物
D. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在着电子与电子、原子核与原子核之间的排斥作用
9. 现有如下各说法
①在水中氢、氧原子间均以化学键相结合。
②金属和非金属化合形成离子键。
③离子键是阳离子、阴离子的相互吸引
④根据电离方程式:HCl=H++Cl-,可判断HCl分子里存在离子键。
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H原子、Cl原子,而后H原子、Cl原子形成离子键的过程。
上述各种说法正确的是( )
A. ①②⑤ B. 都不正确
C. ④ D. ②③④⑤
8. 下列物质中含有相同的化学键类型的是( )
A. NaCl、HCl、H2O、NaOH B. Cl2、Na2S、HCl、SO2
C. HBr、CO2、H2O、CS2 D. Na2O2、H2O2、H2O、O2
7. (2008年高考广东卷·理基)下列化学用语正确的是( )
A. Na2O2中氧元素的化合价为-2
B. 乙醇的分子式:CH3CH2OH
C. 16S的结构示意图: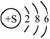
D. 甲烷的结构式: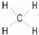
6. 下列物质的电子式书写正确的是( )
①Ca(OH)2 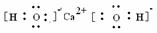
②H2S 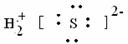 ③OH-
③OH- 
④Al3+ Al3+
⑤N2 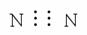
⑥CO2 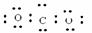
⑦HclO 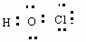
⑧Na2O2 
A. ①②③④ B. ⑤⑥⑦⑧
C. ②③⑤⑥⑦ D. ①④⑧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com