
题目列表(包括答案和解析)
1.(2010江苏高考,8)在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧 B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应 D.亚硫酸钠与稀硫酸反应
解析:本题主要考查氧化还原反应的本质,要求考生掌握硫及其化合物在转化过程中的价态变化,侧重考查考生的审题能力和理解能力。含硫物质被氧化则硫元素的价态升高,B、C选项硫酸中的硫元素化合价降低,D项中硫元素的价态不变。故选A。
答案:A
10.过氧化氢又称双氧水,它是一种二元弱酸,比碳酸的酸性弱,它在受热或碱性条件下极不稳定,易分解生成H2O和O2。随着社会需求的增长,尤其是生态环境保护的需要,双氧水近年来更受到人们的青睐,并称其为绿色氧化剂。根据上述材料,完成下列问题:
(1)写出双氧水的电子式________________________,电离方程式______________________。
(2)双氧水能使高锰酸钾酸性溶液褪色,体现了双氧水的_____________性(填“氧化”“还原”“酸”“碱”,下同);双氧水能使含酚酞的NaOH溶液褪色,体现了双氧水的__________性。
(3)你认为双氧水被称为绿色氧化剂的主要原因是:___________________________________。
(4)已知过氧化钠与干燥的二氧化碳气体不反应,但可以和潮湿的二氧化碳气体发生反应。试用化学方程式表示过氧化钠和潮湿的二氧化碳气体发生反应的过程:____________________。
(5)鉴于H2O2显弱酸性写出它与Ba(OH)2作用形成正盐的化学方程式:__________________。
解析:(1)写物质的电子式首先要判断其化学键的类型,H2O2为共价化合物,即含共价键,再分析元素价态知H显+1价,O显-1价。故其电子式为: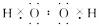 ,由题给信息知,过氧化氢是一种二元弱酸,故电离方程式为:H2O2
,由题给信息知,过氧化氢是一种二元弱酸,故电离方程式为:H2O2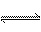 H++
H++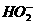 ,
,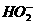
 H++
H++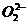 。
。
(2)使高锰酸钾酸性溶液褪色,即体现其还原性。使含酚酞的NaOH褪色,体现了双氧水的漂白性,而答案中无“漂白性”,再联系漂白原理有氧化漂白、化合漂白、吸附漂白三种,双氧水漂白属于氧化漂白,故此种情况下体现了它的氧化性。
(3)联系化学常识,或以题干信息可知所谓“绿色”是指双氧水对环境无污染,因为其还原产物为H2O。
(4)干燥的CO2不与过氧化钠反应,而潮湿的CO2则可以,再联系H2O可与Na2O2反应,且产物中有NaOH,由此,不难分析出CO2与Na2O2反应要有H2O参加,是因为CO2与H2O同Na2O2反应产生的NaOH反应。因此,其反应过程如下:
2H2O+Na2O2====H2O2+2NaOH,
CO2+2NaOH====Na2CO3+H2O
2H2O2====2H2O+O2↑,
我们通常所写的方程式2Na2O2+2CO2====2Na2CO3+O2,是上面三个方程式的总方程式。
(5)由题干信息知双氧水为二元弱酸,故其与Ba(OH)2作用形成的正盐为BaO2,其反应方程式为:H2O2+Ba(OH)2====BaO2+2H2O。
答案:(1) 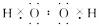
H2O2 H++
H++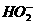 ,
,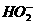
 H++
H++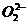
(2)还原 氧化(3)还原产物为水,对环境没有污染
(4)2H2O+Na2O2====H2O2+2NaOH,
CO2+2NaOH====Na2CO3+H2O,
2H2O2====2H2O+O2↑
(5)H2O2+Ba(OH)2====BaO2+2H2O
9.为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:

请完成以下问题:
(1)混合粉末A中硫粉过量的原因是_____________________________________________。
(2)反应在“惰气环境”中进行的原因是__________________________________________。
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明_________________。
(4)操作②的作用是_____________________,反应方程式是__________________________,也可改用加入________________。
(5)操作③稀H2SO4煮沸的目的是________________________________________________。
(6)为证明产物中铁的价态,对D溶液的实验操作最好是____________________________。
解析:只要搞清设计实验的目的和原理,结合硫和铁反应的特点,注意空气的氧化性,问题即可迎刃而解。
答案:(1)防止因铁粉过量而使滤渣C中的铁粉与H2SO4反应,生成Fe2+干扰实验
(2)防止环境中的O2参与反应
(3)硫和铁粉反应是放热的
(4)除去混合物中的硫粉
3S+6KOH 2K2S+K2SO3+3H2O CS2
2K2S+K2SO3+3H2O CS2
(5)防止H2SO4溶解的氧气氧化生成的Fe2+
(6)加入煮沸的KSCN溶液,看是否变为血红色溶液
8.(2010辽宁沈阳质检)世界年产量95%以上的H2O2由蒽醌氧化法生产。反应过程如下:
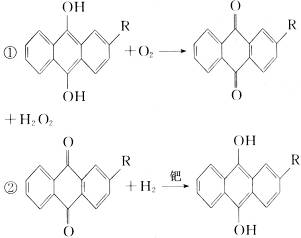
下列说法不正确的是( )
A.H2O2可用作漂白剂、消毒剂,也可作为火箭燃料
B.H2O2可使湿润的KI淀粉试纸变蓝
C.蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2
D.H2O2化学性质稳定,便于储存和运输
解析:A项考查H2O2的用途,此项学生易疏忽;B项方程式为:H2O2+2I-+2H+====I2+2H2O,同时2H2O2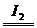 2H2O+O2↑;C项题中两式合并即得H2+O2====H2O2;D项明确H2O2的不稳定性2H2O2====2H2O+O2,此题B项方程式最好要求学生掌握。
2H2O+O2↑;C项题中两式合并即得H2+O2====H2O2;D项明确H2O2的不稳定性2H2O2====2H2O+O2,此题B项方程式最好要求学生掌握。
答案:D
7.臭氧(O3)可使湿润的KI淀粉纸试变蓝,反应为:KI+O3+H2O KOH+I2+O2(未配平),下列结论正确的是( )
KOH+I2+O2(未配平),下列结论正确的是( )
A.O3在反应中被氧化成O2
B.O3的氧化能力大于O2
C.在反应中1 mol O3得到2 mol电子
D.反应中氧化产物O2与还原产物I2的物质的量之比为1∶1
解析:反应方程式配平后为:2KI+O3+H2O====2KOH+I2+O2显然,O3是氧化剂,它的还原产物为KOH;KI是还原剂,它的氧化产物为I2。O2既不是氧化产物也不是还原产物(由O3→O2生成过程中化合价未变,因而不能根据上述反应判断O3和O2氧化性的强弱)。所以A、B、D均不正确。
答案:C
6.(2010山东临沂模拟)意大利一所大学的科学家使用普通的氧分子和带正电的氧离子制造出了一新型氧分子,这种新型氧分子由四个原子构成,其具体结构有待进一步研究。下列对该新型氧分子的性质、用途等预测错误的是( )
A.可用作更强力的火箭推进氧化剂 B.其熔沸点比O2更高
C.是O2的同素异形体,属分子晶体 D.它的摩尔质量为64 g
解析:该新型氧分子由四个氧原子构成,氧单质分子中氧原子数目增多,氧化性增强,A正确。O4分子的相对分子质量大于O2,其熔沸点比O2更高。O2、O3、O4是氧元素形成的不同单质,都是氧的同素异形体,C正确。O4的摩尔质量为64 g·mol-1,D不正确。
答案:D
5.水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是( )
A.蒸馏法是海水淡化的方法之一 B.淡水的密度小于海水的密度
C.融化的雪水中矿物质含量比深井水中的少 D.0 ℃以上,温度越高,水的密度越小
解析:本题考查海水的常识性知识,水的物理性质。蒸馏法可以除去海水中的盐,故可使海水淡化;食盐水的密度大于普通淡水;雨、雪是地面水蒸发再冷凝得到的,其中矿物质含量很低,水在4 ℃时密度最大,故本题应选D。
答案:D
4.硫的非金属性不如氧强,但下列叙述不能说明这一事实的是( )
A.S+O2 SO2,O2是氧化剂,S是还原剂 B.硫是黄色固体,氧气是无色气体
SO2,O2是氧化剂,S是还原剂 B.硫是黄色固体,氧气是无色气体
C.H2S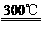 300 ℃H2+S,2H2O
300 ℃H2+S,2H2O 2H2+O2 D.氢硫酸放置在空气中易变浑浊
2H2+O2 D.氢硫酸放置在空气中易变浑浊
解析:硫与氧气化合时,O2作氧化剂、硫作还原剂,说明氧的非金属性比硫强;硫化氢的分解温度比水的分解温度低,硫化氢不如水稳定;氢硫酸放置在空气中易变浑浊,是因为氧将硫置换出来。
答案:B
3.下列物质不能由单质直接化合生成的是( )
①SO2 ②SO3 ③CS2 ④Fe2S3 ⑤CuS ⑥Al2S3
A.①③⑤ B.③④ C.②④⑤ D.①②⑤⑥
解析:本题主要考查S单质的性质及其与多种物质的反应。由于S的氧化性比卤素单质(Cl2、Br2、I2)弱,所以它与变价金属Fe、Cu反应时只能生成低价硫化物。有关反应为:S+O2 SO2,2S+C
SO2,2S+C CS2,S+Fe
CS2,S+Fe FeS,S+2Cu
FeS,S+2Cu Cu2S,3S+2Al
Cu2S,3S+2Al Al2S3。
Al2S3。
答案:C
2.下列说法不正确的是( )
A.硫是一种黄色的不溶于水的晶体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与氧属于同一主族
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
解析:此题全面考查了硫的存在和性质。硫是一种黄色不溶于水的晶体,直接与氧气反应的产物是SO2,SO2被氧气氧化为SO3必须是在有催化剂存在的条件下进行。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com