
题目列表(包括答案和解析)
1.下列有关纯铁的描述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
解析:生铁是铁的合金,对合金来说,其熔点比组成成分的熔点低,故A错误;与盐酸反应时,由于生铁中含有杂质,所以生铁可以在盐酸中形成原电池,加快反应速率;由于同样的原因,在潮湿的空气中,纯铁不易形成原电池,而不易被腐蚀,选择D。
答案:D
10.工业上用铝土矿(主要成分为Al2O3·H2O、Al2O3·3H2O以及少量的Fe2O3、SiO2等)提取Al2O3作冶炼铝的原料。提取的操作过程可用以下流程图表示:
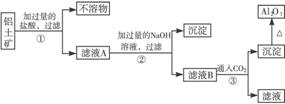
(1)写出步骤②中发生反应的离子方程式__________________________。
(2)写出步骤③中发生反应的离子方程式__________________________。
(3)若步骤①中没有过滤操作而直接进入步骤②,对后面的操作将产生的影响__________。
解析:根据铝、铁及其化合物的性质,结合题中框图可得流程中的各物质为:
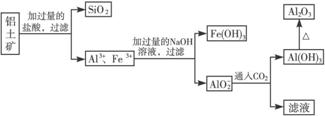
答案:(1)Fe3++3OH-====Fe(OH)3↓;Al3++4OH-====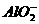 +2H2O
+2H2O
(2)2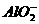 +CO2+3H2O====2Al(OH)3↓+
+CO2+3H2O====2Al(OH)3↓+
(3)如果步骤①中没有过滤操作,SiO2与NaOH反应生成Na2SiO3而进入滤液,在第③步通入CO2后生成硅酸沉淀而混入Al(OH)3,致使得到的Al2O3不纯
9.钛(Ti)因为具有神奇的性能,越来越引起人们的关注。常温下钛不与非金属、强酸反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一--称金红石(TiO2)。目前大规模生产钛的方法是:
第一步:金红石、碳粉混合,在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式为:____________________________,该反应的还原剂是______________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:_________________________________________________。
(2)简述从上述所得产物中获取金属钛的步骤:___________________________________。
解析:化学方程式的书写可直接根据题中所给出的条件和反应物、生成物来写。提取金属钛时,结合题目所给信息,常温下钛不与强酸反应,但镁能溶解,从而选择盐酸提纯。
答案:TiO2+2C+2Cl2 TiCl4+2CO C
TiCl4+2CO C
(1)TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
(2)加入足量盐酸,除去过量金属镁,过滤,并用蒸馏水洗涤固体得金属钛
8.古代的“药金”外观与金相似,常被误以为是金子,冶炼方法如下,将碳酸锌、赤铜(Cu2O),木炭混合加热到800 ℃得金光闪闪的“药金”。
(1)药金的主要成分是________________________。
(2)有关冶炼的化学方程式是__________________。
解析:高温下,碳酸锌分解生成氧化锌和二氧化碳,木炭将Cu2O和ZnO还原为金属铜和锌,故药金的主要成分是铜和锌。
答案:(1)铜、锌
(2)ZnCO3 ZnO+CO2↑;2CuO+C
ZnO+CO2↑;2CuO+C 2Cu+CO2↑;2ZnO+C
2Cu+CO2↑;2ZnO+C 2Zn+CO2↑
2Zn+CO2↑
7.从海水中提取单质镁,下列途径正确的是( )
A.海水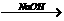 Mg(OH)2
Mg(OH)2 Mg
Mg
B.海水 MgCl2
MgCl2 Mg
Mg
C.海水 Mg(OH)2
Mg(OH)2 MgCl2
MgCl2 Mg
Mg
D.海水 MgCl2
MgCl2 Mg
Mg
解析:海水中含有MgCl2、NaCl等盐类,而镁的制取方法常用的是电解熔融MgCl2,海水中MgCl2浓度很小,所以不能用直接电解海水的方法,需要把海水中的MgCl2先进行处理得到纯净的MgCl2,其过程如下:MgCl2+Ca(OH)2====Mg(OH)2↓+CaCl2,Mg(OH)2+2HCl====
MgCl2+2H2O,得到的MgCl2溶液在加入盐酸的条件下加热蒸发得到MgCl2固体,最后电解熔融的MgCl2得到金属镁。
答案:C
6.下列说法错误的是( )
A.回收照相业中的定形液可提取镁 B.回收不锈钢可提取铬或镍以及铁
C.回收可口可乐易拉罐可回收铝 D.回收精炼铜的阳极泥可得金、银等贵金属
解析:本题主要考查生活中常见物质的组成元素。不锈钢的主要成分是铁,并含有少量碳、铬、镍;易拉罐为铝制品;而精铜中则含有金、银等杂质,故B、C、D都正确。照相底片上涂有AgBr,故从定影液中可提取银而不是镁。
答案:A
5.H2作还原剂和金属作还原剂相比,制得金属的纯度说法正确的是( )
A.用H2的高 B.用金属的高
C.二者相同 D.无法比较
解析:氢气和金属虽然都可作还原剂制得金属,但金属作还原剂时的过量金属氧化产物和还原产物多为固体,易使制得的金属中含有杂质,而H2的氧化产物为水,则不会引入杂质。
答案:A
4.铝能用于冶炼难熔的金属,这是因为( )
A.铝具有两性
B.铝具有低熔点性质
C.铝具有导电性好的性质
D.铝具有较强的还原性,在冶炼反应中能放出大量的热
解析:难熔的金属一般化学性质较不活泼,其离子的氧化性较强,易被还原性强的金属铝还原,且在反应过程中放出大量的热使其熔化。
答案:D
3.下列各种冶炼方法中,可制得相应的金属的是( )
A.加热氧化铝 B.加热碳酸钙
C.电解熔融氯化钠 D.氯化钠与铝粉高温共热
解析:铝为活泼金属,氧化铝受热很难分解,加热氧化铝不能制得铝,A不正确。钙的化学性质活泼,加热碳酸钙可得到分解产物氧化钙,无法制得金属钙,B不正确。电解熔融的氯化钠可制得金属钠,钠比铝活泼,氯化钠与铝不反应,D不正确。
答案:C
2.金属的下列性质与金属晶体无关的是( )
A.良好的导电性 B.反应中易失电子
C.良好的延展性 D.良好的导热性
解析:金属有许多共同性质,像容易导电、导热,有延展性等。这些性质都与金属晶体有关,而反应中易失电子属于金属原子的性质,与金属晶体无关。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com