
题目列表(包括答案和解析)
10.关于如图所示装置的叙述正确的是( )
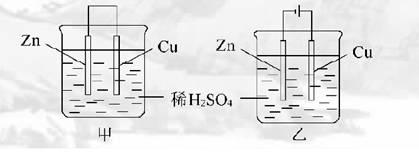
A.甲乙装置中的锌片都做负极
B.甲乙装置中的溶液内的H+在铜片上被还原
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减小
解析:甲为原电池,乙为电解池,锌片分别做负极与阴极,H+分别在铜片与锌片上还原,锌片上发生的分别是氧化反应与还原反应。甲中铜片上H+被还原有气泡生成,乙中铜电极被氧化生成Cu2+,铜片质量减小。
答案:D
9.复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验。滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹。据此判断电极材料与反应现象均正确的是( )

|
|
滤纸混合溶液 |
d极反应产物 |
阴极反应产物 |
字体颜色 |
|
A |
氯化钠、无色酚酞 |
Fe2+ |
氢气 |
红色 |
|
B |
碘化钾、淀粉 |
Cu2+ |
氢气 |
紫色 |
|
C |
硫酸钠、无色酚酞 |
Fe2+ |
氧气 |
红色 |
|
D |
碘化钾、淀粉 |
Cu2+ |
氢气 |
蓝色 |
解析:A项电解NaCl可在阴极使酚酞显红色,则a为阴极,产生H2,d极为正极,产物为Fe2+;B、D项电解KI可在阳极产生I2使淀粉显蓝色,则a端为阳极产生I2,阴极产生H2,d极为负极生成Cu2+;C项电解Na2SO4溶液实质为电解H2O,则a端显红色,说明a端为阴极产生H2,d端为正极生成Fe2+。
答案:AD
8.我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为硬币制作时,钢芯应该做( )
A.正极 B.负极 C.阳极 D.阴极
解析:电镀时镍离子在钢芯上发生还原反应,故钢芯做阴极。
答案:D
7.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
解析:铜、铁是两种活泼性不同的金属,稀硫酸是电解质溶液,三者共同形成原电池,铁片上发生氧化反应:Fe-2e-===Fe2+,铜片上发生还原反应:2H++2e-===H2↑,故A选项正确。
答案:C
6.(2009·安徽蚌埠)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.将甲、乙做电极组成原电池时,甲是正极
解析:A项中失电子多少不能说明失电子难易,例如Al与Na;B项中甲的阳离子氧化性强,则甲的还原性弱;C项正确;D项中甲做正极,则甲不如乙活泼。
答案:C
5.有一种锂电池,用金属锂和石墨做电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工做过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工做过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
解析:由电池总反应可知,Li失电子,做电池的负极,石墨做电池的正极,故B选项不正确;Li为碱金属,易与水发生反应:2Li+2H2O===2LiOH+H2↑,故A选项不正确;电池工作过程中,SOCl2被还原为S,故C选项不正确;由电池总反应式知,8 mol Li参与反应,可提供8 mol e-,同时在正极析出2 mol S,故本题正确选项为D。
答案:D
4.下列有关金属的说法正确的是( )
A.银器在空气中变暗后一定条件下被还原又会变光亮
B.当镀锌铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.不锈钢不生锈是因为表面有保护膜
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
解析:A项,当银的化合物又变成单质银时可以变光亮。B项,锌比铁活泼,所以镀层破损后仍与铁构成原电池做负极,铁被保护。C项,不锈钢不生锈是因为内部结构原因而具有强的耐腐蚀能力。D项,要使地下输油钢管不生锈,应该与外加电源的负极相连。
答案:A
3.如图所示,下列叙述正确的是( )

A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
解析:图中左边装置是以Zn、Cu为电极的原电池装置,该电池中,Zn极为负极,Cu极为正极,而右边为电解池,根据连接情况可以推知,X为阳极,发生氧化反应,Y为阴极,发生还原反应,两极的电极反应式分别为X:4OH--4e-===2H2O+O2↑,Y:2H++2e-===H2↑,从而可得出答案应为A。
答案:A
2.铁锈的成分中含有铁的氧化物、铁的氢氧化物。研究证明,铁器的生锈与大气中的氧气、水蒸气有关。下列做法中最有利于减缓铁器生锈的是( )
A.铁锅用完后用水刷洗干净其表面的油污
B.久置不用的铁刀涂抹凡士林在空气中保存
C.将铁壶盛水后保存
D.铁勺、铁铲放在阴湿处保存
解析:铁锅表面的油污用水刷洗掉后,铁直接与空气接触,而且铁锅刷洗后,表面有水,极易生锈;铁刀用凡士林涂抹后,使Fe与空气隔绝,可以减缓其生锈;铁器接触水,或在潮湿的空气中容易发生电化学腐蚀而生锈。
答案:B
1.由化学能转变的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是( )

A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e-===2H2O
D.该装置中a极为正极,发生氧化反应
解析:该装置的左边是燃料电池,右边是电解池。a极为正极,发生还原反应;Cu极与电池正极连接,故为阳极;当铜片溶解了12.8 g时,失去了电子12.8 g÷64 g/mol×2=0.4 mol,于是a极上O2得到电子也是0.4 mol,则消耗O2的物质的量是0.1 mol,在标准状况下的体积为2.24 L。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com