
题目列表(包括答案和解析)
21.有七种金属:钠、铝、铁、锡、铜、银、金,它们的标号分别为A、B、C、D、E、F、G。①常温下,只有A和水反应生成氢气;②D、E、G都能和稀硫酸反应生成氢气;③D、E、G中只有D与NaOH溶液反应;④B、F组成原电池时,F为正极;⑤将G、E组成的合金暴露在潮湿的空气中,经一段时间后,合金的表面有G的化合物出现;⑥用石墨电极电解含有相同物质的量浓度的B和C两种金属的硝酸盐溶液,B的单质先析出。回答下列问题:
(1)B的元素符号是________;G元素在元素周期表中的位置是________。
(2)D的最高价氧化物与A的最高价氧化物对应水化物发生反应的离子方程式为________________________。D的单质与G的最高价氧化物发生反应的化学方程式为____________________________,该反应在生产中有重要应用,被称为________反应。
(3)写出⑥中的电极反应式:阳极:_________________________________________,
阴极____________________________________________________________。
(4)将C的氯化物溶液蒸干灼烧得到的固体物质是________,原因是________________________________________________________________________
__________________________(用必要的文字和离子方程式表示)。
答案:(1)Ag 第四周期Ⅷ族
(2)Al2O3+2OH-===2AlO+H2O
2Al+Fe2O32Fe+Al2O3 铝热
(3)4OH--4e-===O2↑+2H2O
Ag++e-===Ag
(4)CuO CuCl2加热水解CuCl2+2H2OCu(OH)2+2HCl,随着HCl的挥发平衡右移,生成的Cu(OH)2经灼烧后分解生成了CuO
20.由于Fe(OH)2在空气中易被氧化,同学们为了观察到白色的Fe(OH)2固体想了很多方法。甲同学:在如图所示装置中,用铁屑、6 mol·L-1的硫酸、NaOH溶液制备。
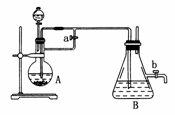
(1)实验开始时应先将活塞a________,活塞b________(填“打开”或“关闭”)。
(2)为了制得Fe(OH)2沉淀,在装置A和B中加入试剂后的实验步骤为________________________________________________________________________。
(3)这样生成的Fe(OH)2沉淀能较长时间不变色,其理由是________________________________________________________________________
________________________________________________________________________。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为________________________________________________________________________
________________________________________________________________________。
(5)下列各图示中________能较长时间看到Fe(OH)2白色沉淀。
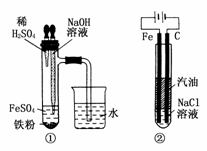
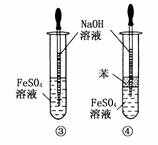
乙同学:只是将甲同学所用药品中的铁屑改为FeS固体,其余都与甲相同。
(6)对乙同学的这一改变请你作出评价:____________________________________
________________________________________________________________________。
答案:(1)打开 关闭
(2)检验装置B出口处排出的H2的纯度,当排出的H2纯净时,关闭活塞a
(3)装置A中反应生成的H2充满了装置A和装置B,且外界空气不容易进入
(4)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(5)①②④
(6)反应中生成的H2S也能防止Fe(OH)2被氧化,白色沉淀能存在较长时间,但易产生空气污染物
19.(2009·莆田模拟)某同学在一只烧杯里装有a g纯铁粉,加入200 mL 6 mol/L硝酸恰好完全溶解铁粉(假设还原产物只有NO)。请完成对产物中铁元素价态的探究:
(1)提出合理假设:
假设1:产物只有+2价铁;
假设2: __________________________________________;
假设3: _________________________________________。
(2)设计实验:分别取反应后溶液装入两支试管甲、乙,在甲试管中滴加酸性高锰酸钾溶液;在乙试管中滴加KSCN溶液,观察现象。
推测实验现象与结论:①若现象为: _________________________________________,
则假设1正确;②若现象为: __________________________________________,
则假设2正确;③若现象为: ___________________________________________,
则假设3正确。
(3)a值范围为_________________________________________。
答案:(1)产物中只有+3价铁元素
产物中既含+2价又有+3价铁元素
(2)①甲试管溶液紫色褪去,乙试管没有明显变化
②甲试管溶液无明显变化,乙试管溶液变红色
③甲试管溶液颜色褪去,乙试管溶液变红色
(3)16.8≤a≤25.2
18.下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。
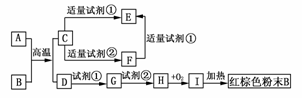
试推断:
(1)写出物质的化学式:A:________、C:________、I:________。
(2)写出下列反应的方程式:
C―→F的离子方程式___________________________。
H―→I的化学方程式_______________________。
解析:根据红棕色粉末可知B为Fe2O3,则I、H、G、D依次为Fe(OH)3、Fe(OH)2、Fe2+、Fe。A、D为金属单质,则A+BC+D为置换反应,C为金属化合物,试剂①为HCl,试剂②为NaOH,既能与酸反应,又能与碱反应的金属化合物C应为Al2O3,其余问题可迎刃而解。
答案:(1)Al Al2O3 Fe(OH)3
(2)Al2O3+2OH-===2AlO+H2O
4Fe(OH)2+O2+2H2O===4Fe(OH)3
17.(2009·广东)下列除去杂质的方法正确的是 ( )
A.除去CO2中混有的CO:用澄清石灰水洗气
B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
解析:A中除去的是CO2;B中除去的是BaCO3;D中Cu粉也能与稀HNO3反应。
答案:C
16.(2009·广东)出土的锡青铜(铜锡合金)文物常有Cu2(OH)3Cl覆盖在其表面。下列说法正确的是 ( )
A.锡青铜的熔点比纯铜高
B.在自然环境中,锡青铜中的锡对铜起保护作用
C.锡青铜文物在潮湿环境中的腐蚀比干燥环境中快
D.生成Cu2(OH)3Cl覆盖物是电化学腐蚀过程,但不是化学反应过程
解析:A项:合金的熔点比任何一种成分的纯金属低;D项:生成Cu2(OH)3Cl发生了化学反应。
答案:B、C
15.(2009·深圳)用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按下图所示步骤分开五种离子,则溶液①②③④是 ( )
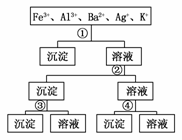
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①NaCl ②NH3·H2O ③NaOH ④H2SO4
解析:加入①时,只产生一种沉淀,故①一定是NaCl,沉淀为AgCl;在滤液中加入②后,生成两种沉淀,故②是NH3·H2O或NaOH,而生成的沉淀有一种在③中溶解,故②为NH3·H2O,③为NaOH,则④为H2SO4。
答案:D
14.(2009·安庆模拟)金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cCaTiCl4+cCO 反应Ⅰ
TiCl4+2MgTi+2MgCl2 反应Ⅱ
(Ti的相对原子质量为48)
关于反应Ⅰ、Ⅱ的分析不正确的是 ( )
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应Ⅰ、Ⅱ中Mg的还原性大于Ti,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④
C.③④ D.②⑤
解析:反应Ⅰ的化学方程式为:
TiO2+2Cl2+2CTiCl4+2CO
反应中C作还原剂被氧化,Cl2作氧化剂,TiCl4为还原产物,其还原性C>TiCl4。
反应Ⅱ的方程式为:
TiCl4+2MgTi+2MgCl2
该反应中,Mg作还原剂,还原产物为Ti,即还原性Mg>Ti,从反应Ⅰ、Ⅱ可知,每生成=0.4 mol Ti时,共转移电子的物质的量为:0.4 mol×(4+4)=3.2 mol。
答案:D
13.(2009·威海模拟)元素A的单质及A与B形成的化合物能按如图所示的关系发生转化。则下列说法正确的是 ( )
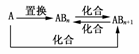
A.图中物质间的转化都不是氧化还原反应
B.当n=1时,A可能是N2
C.A一定是金属元素
D.当n=2时,A可能是Fe
答案:D
12.(思维拓展题)向一定量的FeO、Fe、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)的气体,在所得溶液中经检验无Fe3+。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是 ( )
A.11.2 g B.5.6 g
C.2.8 g D.无法计算
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com