
题目列表(包括答案和解析)
1.下列说法正确的是 ( )
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.Na+的半径大于F-的半径
C.F-、Na+、Al3+、Cl-与Ne原子具有相同电子层结构
D.NH和H3O+具有相同的质子数和电子数
答案:D
21.A、B、C、D均为短周期主族元素,A和B同周期相邻,A和C同主族相邻,三种元素的原子序数之和为31。D元素与A、B、C三元素既不同周期、也不同主族。回答下列问题:
(1)写出下列元素的名称:
A________,B________,C________,D________。
(2)A和C的单质可直接化合生成化合物X,反应的化学方程式为__________________________;X对环境的影响为____________________________。
(3)A、B、D可组成离子化合物,是一种常见的速效化肥,其化学式为________;长期使用该化肥将导致土壤酸化,其原因用离子方程式表示为_______________________;
在该化合物的水溶液中,各离子浓度由大到小的正确顺序是___________________。
解析:本题是建立在元素推断基础上的综合题,首先根据题设条件推断出四种元素是什么,再进行综合解题。A和B同周期相邻,且原子序数相差1,A和C同主族相邻,则原子序数相差8,三种元素的原子序数之和为31,则三种元素分别为O、N、S。D元素与A、B、C既不同周期又不同主族,应为H元素,由此可解答下列各题。
答案:(1)氧 氮 硫 氢
(2)S+O2催化剂△SO2 导致酸雨
(3)NH4NO3
NH+H2ONH3·H2O+H+
c(NO)>c(NH)>c(H+)>c(OH-)
20.短周期元素A、B、C、D,0.5 mol A元素的离子得到6.02×1023个电子后被还原为中性原子,0.4 g A的氧化物恰好与100 mL 0.2 mol/L的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请填写下列空格:
(1)A、B、C、D四种元素的符号是A________,B________,C________,D________。
(2)C、D两元素组成的物质,分子内含有________键(填“极性”或“非极性”,下同)。
(3)B与D的最高价氧化物对应的水化物的酸性强弱B________D(填“>”、“<”或“=”)。
(4)B的最高价氧化物对应的水化物体现________(填“酸性”、“碱性”或“两性”),能证明该性质的离子方程式表示为___________________________________________。
解析:0.5 mol A元素的离子得到6.02×1023个电子被还原为中性原子,则A元素形成的离子为A2+,氧化物形式为AO,根据AO与盐酸反应的量的关系:
M(AO)==40 g·mol-1,所以A元素原子的质量数为40-16=24,因为A元素原子核内质子数和中子数相等,所以A为Mg,由题意依次推知B为Al,C为Cl,D为C。
答案:(1)Mg Al Cl C
(2)极性 (3)<
(4)两性
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===AlO+2H2O
19.(2009·宿州模拟)有①-⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
|
② |
|
|
|
|
|
|
⑦ |
⑧ |
(1)元素②在周期表中的位置为________;②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是______________________(用化学式表示)。
(2)如图所示,甲、乙、丙、丁均为①-⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应。单质乙与单质丙所含元素位于同一主族,试写出符合条件的反应a的两个化学方程式:____________________________________________________、
________________________________________________________________________。
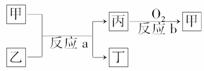
解析:由元素②所处主族正中间,且为第二周期,可知②为碳元素,则⑦为硫元素,⑧为氯元素,②⑦⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3。
短周期元素中能发生主族间的置换反应的有①2Na+2H2O===2NaOH+H2↑,②SiO2+2CSi+2CO↑,③2H2S+O22H2O+2S,符合上述条件的是①、②。
答案:(1)第二周期ⅣA族
HClO4>H2SO4>H2CO3
(2)2Na+2H2O===2NaOH+H2↑
SiO2+2CSi+2CO↑
18.下列说法正确的是 ( )
A.最外层电子数为次外层电子数一半的元素一定属于碱金属元素
B.元素周期表中从第ⅢB族到第ⅡB族之间10个纵行的元素都是金属元素
C.同周期第ⅡA族与第ⅢA族元素的原子序数相差1或11或25
D.若主族元素的族序数为a,周期数为b,当<1时,该元素为非金属元素
答案:BC
17.(2009·浙江诸暨高二期末)最近,科学家发现了氧元素的一种新的粒子O4,并用质谱仪探测到了它存在的证据。若该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是 ( )
A.是氧元素的一种同位素
B.是氧气的同素异形体,分子内不含有极性键
C.是一种新的氧化物
D.是臭氧的同分异构体
答案:B
16.下列有关碱金属元素的叙述中,正确的是 ( )
A.碱金属元素的离子具有很强的氧化性
B.碱金属元素的单质是很强的还原剂
C.锂与水的反应比钠与水的反应剧烈
D.铯的熔点比钠低
答案:BD
15.我国科研人员在兰州合成了镤元素的一种同位素镤239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤239的原子核少54个质子和100个中子。则A元素在周期表中的位置是 ( )
A.第三周期第ⅠA族 B.第四周期第ⅠA族
C.第五周期第ⅠA族 D.第二周期第ⅡA族
答案:C
14.某第ⅡA族元素的原子序数为a,则原子序数为a+1的元素 ( )
A.一定是第ⅢA族元素
B.可能是第ⅡA族元素
C.一定是第ⅢB族元素
D.可能是第ⅢA或第ⅢB族元素
答案:D
13.(2008·四川非延考区)下列叙述中正确的是 ( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
解析:A项中F的最高化合价为0价,与族序数不等;B项中六、七周期所含元素数均不是18种;D项中H不属于碱金属。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com