
题目列表(包括答案和解析)
19.某亚硫酸钠试剂,已部分被氧化。为确定其纯度,要进行如下实验:①称取样品W1 g;②将样品溶解;③向溶液中加入稍过量盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g,回答:
(1)BaCl2要用盐酸酸化的原因是____________________________。
(2)BaCl2溶液要稍过量的原因是____________________________。
(3)判断操作③完成的方法是____________________________。
(4)判断沉淀洗净的方法是____________________________。
(5)Na2SO3纯度的表达式:____________________________。
答案:(1)完全除去Na2SO3,避免生成BaSO3沉淀 (2)使SO完全沉淀 (3)在上层清液中继续加入盐酸酸化的BaCl2溶液,无沉淀产生 (4)在最后一次洗涤液中加入AgNO3溶液,无白色沉淀产生 (5)1-×100%
18.(2009·靖江模拟)“北、京、欢、迎、您”分别代表五种不同颜色的单质,它们之间相互交叉形成了如图所示的奥运五环旗,A、B、C、D、E、F、G、H是由相交叉的两环元素组成的化合物。
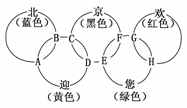
已知:蓝色的“北”是液态O2,红色的“欢”是固态非金属单质,1 mol G可与1 mol“您”恰好反应生成1 mol H,F的溶液可与A反应生成酸M、酸N和E的溶液,C高温煅炼可制得A,此反应是工业上制取酸M的基础反应。请回答下列问题:
(1)“京”是________,“欢”的同素异形体是________。
(2)写出F的溶液与A反应生成酸M、酸N和E的溶液的化学方程式:__________________________,该反应为氧化还原反应,还原产物为___________________。
(3)工业上以C为基础原料,制取酸M产生的工业尾气直接排放到大气中会造成环境污染,处理该尾气得到一种化肥,写出该肥料的化学式:___________________________。
答案:(1)铁 白磷
(2)2FeCl3+SO2+2H2O===H2SO4+2HCl+2FeCl2 FeCl2
(3)(NH4)2SO4
17.某待测溶液中可能含有SO、SO、CO、Cl-、NO、HCO、S2-等离子,进行下列实验如图所示[所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量]。
待测液
(1)判断待测溶液中有无SO、SO,并说明理由_____________________________
________________________________________________________________________。
(2)沉淀B为______________________________________________________________。
(3)沉淀A可能是__________________________________________________________。
(4)写出生成沉淀B的离子方程式:___________________________________________。
答案:(1)SO、SO至少有一种;因为沉淀D不溶于稀HNO3,一定为BaSO4,它可能由BaSO3氧化而来,也可能由Ba2+与SO生成
(2)S
(3)BaSO4、BaCO3或BaSO3、BaCO3或BaSO4、BaSO3和BaCO3
(4)S2-+Cl2===S↓+2Cl-
16.(2009·北京)下列叙述正确的是 ( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不改变
解析:A项:弱酸一般不能制强酸,错误;B项:加入Cu(NO3)2因反应3Cu+8H++2NO===3Cu2++2NO↑+4H2O使铜粉溶解,错误;D项:因形成原电池使反应速率加快,错误。
答案:C
15.(2009·山东)下列推断合理的是 ( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
解析:B项:金刚石可在O2中燃烧;C项:Cu与浓H2SO4在常温下不反应;D项:SO2通入溴水,SO2被氧化成SO,加热后不会恢复原色。
答案:A
14.(2009·合肥模拟)如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是 ( )
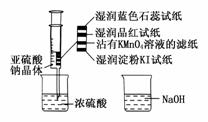
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
答案:D
13.(思维拓展题)下列实验过程中产生的现象与对应的图形相符合的是 ( )

解析:A选项中,NaHSO3能被HNO3氧化成Na2SO4,HNO3被还原,若产生气体,则只要加入NaHSO3就应有气体产生,图像错;B选项中H2S+Cl2===S↓+2HCl,因生成HCl,则与氯水反应过程中pH应减小,图像错;C项中Ba(HCO3)2+2NaOH===BaCO3↓+Na2CO3+2H2O,则NaOH溶液滴入Ba(HCO3)2溶液中立即产生BaCO2沉淀,图像错;D项中CO2+Ca(OH)2===CaCO3↓+H2O,当Ca(OH)2完全反应后,继续通入CO2,又发生CaCO3+CO2+H2O===Ca2++2HCO,这样最后溶液中离子浓度跟反应前Ca(OH)2溶液中离子浓度相同,图像正确。
答案:D
12.锌与一定量的浓H2SO4反应后生成了标准状况下的混合气体22.4 L,则消耗锌的质量为 ( )
A.65 g B.56 g
C.32.5 g D.130 g
答案:A
11.有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下列叙述正确的是 ( )
A.Na2SO3已部分被空气中的氧气氧化
B.加入Ba(NO3)2溶液后,生成的沉淀中一定会有BaSO4
C.加硝酸后的不溶沉淀是BaSO4和BaSO3的混合物
D.此实验不能确定Na2SO3是否部分被氧化
答案:D
10.把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
( )
A.SO2 B.Fe2+ C.Fe3+ D.NO
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com