
题目列表(包括答案和解析)
7.将溶质的质量分数为a%、物质的量浓度为c1 mol/L的稀硫酸加热蒸发掉一定量的水使溶质的质量分数变为2a%,此时硫酸的物质的量浓度为c2 mol/L。则c1和c2的关系为
( )
A.c1=c2 B.c1>c2
C.2c1<c2 D.2c1=c2
答案:C
6.(2009·罗定模拟)实验室用下列溶质配制一种混合溶液,已知溶液中c(K+)=c(Cl-)=c(Na+)=c(SO),则其溶质可能是 ( )
A.KCl Na2SO4 B.KCl Na2SO4 NaCl
C.NaCl K2SO4 D.KCl K2SO4 Na2SO4
答案:A
5.实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是 ( )
A.950 mL 111.2 g B.500 mL 117.0 g
C.任意规格 111.2 g D.1000 mL 117.0 g
答案:D
4.2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是 ( )
A.取KMnO4样品时不慎在表面沾了点蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶刻度线
D.摇匀后见液面下降,再加水至刻度线
解析:A项取得样品质量偏小,使溶液浓度偏低,B项液体飞溅损失一部分KMnO4,使溶液浓度偏低,C项定容时俯视导致加水量较少浓度偏高,D项加水量过多,使溶液浓度偏低。
答案:C
3.用98%的浓硫酸(密度为1.84 g·cm-3)配制1 mol·L-1的稀硫酸100 mL,按配制溶液时仪器的选用顺序排列,正确的是:①玻璃棒 ②胶头滴管 ③100 mL容量瓶 ④托盘天平 ⑤50 mL烧杯 ⑥10 mL量筒 ⑦100 mL量筒 ( )
A.⑦③⑤①② B.⑥⑤③①②
C.④⑤③②① D.⑥⑤①③②
答案:D
2.(2008·四川高考)在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO离子完全沉淀;如加入足量强碱并加热可得到c mol NH3气,则原溶液中的Al3+离子浓度 (mol/L)为 ( )
A. B.
C. D.
答案:C
1.(2009·济南模拟)下列说法中错误的是 ( )
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.制成0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%硫酸(密度为1.84 g·cm-3)与10 mL18.4 mol·L-1硫酸的浓度是不同的
答案:D
18.(2008·东营模拟)加热0.04 mol KMnO4固体,一段时间后,收集到a mol单质气体,此时KMnO4的分解率为x,在反应后的残留固体中加入过量的浓HCl并加热,充分反应后又收集到b mol单质气体,设Mn元素全部以Mn2+存在于反应后的溶液中。
(1)a+b=________(用x表示)。
(2)当x=________时(a+b)取最小值,且最小值为________。
(3)当a+b=0.09时,0.04 mol KMnO4加热后所生成残留固体的质量为________。
解析:n(O2)可由2KMnO4K2MnO4+MnO2+O2↑求得,a=0.02x mol。
由2KMnO4+16HCl===2MnCl2+2KCl+5Cl2↑+8H2O;
K2MnO4+8HCl===MnCl2+2KCl+2Cl2↑+4H2O;
MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
可求得n(Cl2),
b=0.04(1-x) mol×5/2+0.04x mol+0.04x mol/2
=(0.1-0.04x) mol
(1)n(O2)+n(Cl2)=a+b=0.02x mol+0.1 mol-0.04x mol/2
=(0.1-0.02x) mol
(2)在上述推得的数学关系式a+b=0.1-0.02x中,x为分解率。由0<x<100%和数学极值原理可求得:0.08<a+b<0.1,即KMnO4完全分解(x=100%)时,a+b值最小为0.08。
(3)当a+b=0.09时,求得x=50%,由高锰酸钾分解反应式得:n(O2)=0.01 mol,则由质量守恒定律知:加热后剩余固体的质量等于原KMnO4,质量与放出O2质量的差,m(剩)=0.04 mol×158 g·mol-1-0.01 mol×32 g·mol-1=6g。
答案:(0.1-0.02x) (2)100% 0.08 (3)6 g
|

|
17.某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答下列问题。
该小组设计的简单实验装置如图所示:
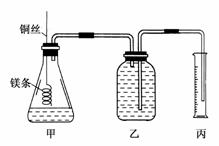
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用________(填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法:
________________________________________________________________________
________________________________________________________________________。
(2)实验步骤⑤中应选用________(填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意________________________________________。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=________,若未除去镁条表面的氧化膜,则测量结果________(填“偏大”、“偏小”或“无影响”)。
解析:本题以化学计量和化学实验基础知识为背景,通过化学实验的形式考查气体摩尔体积的测定,探究实验中出现的问题,符合当前新课改的探究理念。
考虑到②10 mL量筒的精确度是0.1 mL,故应用10 mL量筒;③因HCl的物质的量为0.01 mol,由反应Mg+2HCl===MgCl2+H2↑知,HCl可与0.005 mol Mg完全反应,为保证HCl完全反应,故镁应不少于0.005 mol×24 g/mol=0.12 g。
(1)本装置可与初中化学制氢气的装置联系,用微热的方法检查装置的气密性。
(2)实验中产生的气体在标准状况下的体积为0.005 mol×22.4 L/mol=0.112 L=112 mL,考虑到室温时气体的体积稍大些,再考虑通常仪器规格应略大且越接近,误差越小,故选B。读数时注意量筒内的液面与集气瓶中液面相平,保证气压相等。
(3)Vm是气体的体积(排出水的体积)与气体的物质的量之比。若未除去表面的氧化膜,导致氧化膜耗酸,从而放出H2的体积变小,则Vm偏小。
答案:②10 mL量筒 ③0.12
(1)两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好。
(2)B 量筒内的液面与集气瓶内液面相平
(3)0.2V L·mol-1 偏小
16.在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2物质的量比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,对氢气的相对密度是________。
答案:1:3 25% 17.5% 4:7 40 20
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com