
题目列表(包括答案和解析)
8.(2008·广东高考)将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 ( )
A.a>b B.a=b C.a<b D.无法确定
答案:A
7.(2009·东城模拟)一密闭容器中发生反应:2SO2(g)+O2(g)2SO3(g) ΔH<0,如图表示该反应的速率(v)在某一时间段内的变化。则下列时间段中,SO3的百分含量最高的是
( )

A.t0→t1 B.t2→t3 C.t3→t4 D.t3→t5
答案:A
6.(2009·安微六校联考)固体NH4I放入一个体积为V L的真空密闭容器中,加热至一定温度后,恒温下发生下列反应:NH4I(s)
 NH3(g)+HI(g);2HI(g)
NH3(g)+HI(g);2HI(g)
 H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是 ( )
H2(g)+I2(g)。平衡时,测得容器中气体共为5 mol,其中HI为1.5 mol,则下列说法正确的是 ( )
A.平衡时氨气为2.5 mol
B.平衡时HI的分解率为20%
C.若开始时放入固体NH4I的量增大一倍,则平衡时气体共为10 mol
D.其他条件不变把容器的体积缩小到 L,重新达到平衡时H2的浓度是原平衡的2倍
解析:设达平衡时,容器中NH3为a mol,则NH4I分解生成HI也为a mol,平衡时剩余HI为1.5 mol,故在反应
2HI(g)H2(g)+I2(g)中消耗HI为(a-1.5)mol,同时生成H2和I2的物质的量之和为(a-1.5)mol,因此有关系式a+1.5+(a-1.5)=5,a=2.5
mol,A项正确;平衡时HI的分解率为 ×100%=40%,B项错误;因为NH4I为固态,改变其用量平衡不移动,C项错误;当其他条件不变,减小容器体积到,因平衡NH4I(s)
 NH3(g)+HI(g)也向逆反应方向移动导致平衡2HI(g)
NH3(g)+HI(g)也向逆反应方向移动导致平衡2HI(g)
 H2(g)+I2(g)也向逆向移动,使新平衡中H2浓度小于原平衡的2倍。
H2(g)+I2(g)也向逆向移动,使新平衡中H2浓度小于原平衡的2倍。
答案:A
5.(2009·四川高考)在密闭容器中进行如下反应:H2(g)+I2(g)
 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是 ( )
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如图所示。符合图示的正确判断是 ( )
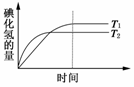
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
答案:D
4.如图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是 ( )
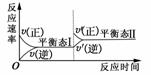
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
答案:C
3.下列说法正确的是 ( )
A.ΔH<0、ΔS>0的反应在温度低时不能自发进行
B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g);ΔH=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
答案:B
2.
 (2008·全国Ⅱ)在相同温度和压强下,对反应CO2(g)+H2(g)
(2008·全国Ⅱ)在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表。
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表。

|
物 |
|
质 |

|
|
|
|
|
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙=丁>丙=甲 B.乙>丁>甲>丙
C.丁>乙>丙=甲 D.丁>丙>乙>甲
解析:依题意列举为
CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
甲: a mol a mol 0 0
乙: 2a mol a mol 0 0
丙: 0 0 a mol a mol
丁: a mol 0 a mol a mol
采用“一边倒”得甲与丙相同(等效),乙与丁等效,乙相当于在甲已达到平衡的基础上再增加a mol CO2,平衡正向移动使乙中n(CO)大于甲中n(CO)。
答案:A
1.(2009·山东省烟台市高三模块考试)可逆反应CO+NO2 CO2+NO的反应速率与反应物浓的关系为v=kc(NO2)。一定温度下,该反应在一定体积的密闭容器中达到平衡状态,此时向容器中充入一定量的CO气体,下列叙述错误的是 ( )
CO2+NO的反应速率与反应物浓的关系为v=kc(NO2)。一定温度下,该反应在一定体积的密闭容器中达到平衡状态,此时向容器中充入一定量的CO气体,下列叙述错误的是 ( )
A.正反应速率增大,平衡向正反应方向移动
B.浓度商Qc减小,平衡向正反应方向移动
C.反应物的焓增大,平衡向正反应方向移动
D.CO气体分压增大,平衡向正反应方向移动
[答案] A
22.在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=__________。
(2)已知在700℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)
 CO2(g)+H2(g)的平衡常数K2=__________,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K3=__________________。
CO2(g)+H2(g)的平衡常数K2=__________,反应CO2(g)+H2(g)CO(g)+H2O(g)的平衡常数K3=__________________。
(3)已知在1000℃时,该反应的平衡常数K4为1.0,则该反应为__________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是__________________。
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1000℃下,某时刻CO2的物质的量为2.0 mol,则此时v(正)__________v(逆)(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为__________。
答案:(1)
(2)1.67 0.77 (3)吸热
(4 )C (5)> 40%
10.(3) 94.7% (4)5 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com