
题目列表(包括答案和解析)
22.(12分)(2008·宁夏理综,26)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
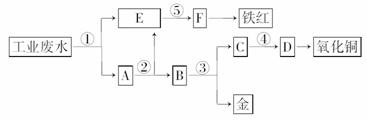
填写下面空白。
(1)图中标号处需加入的相应物质分别是①__________、②__________、③__________、④__________、⑤__________;
(2)写出①处发生反应的离子方程式__________________,写出③处发生反应的化学方程式____________________________;
(3)铁红的化学式为__________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红__________;氧化铜__________。
解析:本题主要考查了元素与化合物有关知识,通过对工业废水的处理,题目设计了高中重要的元素Fe、Cu的有关性质内容,涉及内容主要有物质推断、化学用语、物质用途等。在解此题时宜采用逆向推断法,从题中给出信息可知,首先分离的应是铁元素,所加最佳试剂应是铁粉,E溶液就为Fe2+,铁红成分为Fe2O3,可联想到高中重要反应2Fe(OH)3Fe2O3+3H2O,试剂⑤应为可溶性碱(NaOH或氨水);当加入过量铁粉后,所得A应为固体Fe、Cu、Au的混合物,此时,只需加入稀硫酸(试剂②)后过滤可得Cu、Au混合物B,再加入稀硝酸试剂③可使Cu、Au得到分离,Cu(NO3)2加可溶性碱后加热得到CuO。
答案:(1)①铁屑 ②稀硫酸 ③稀硝酸 ④氢氧化钠 ⑤氢氧化钠
(2)Fe+2H+===Fe2++H2↑,2Fe3++Fe===3Fe2+
Cu2++Fe===Cu+Fe2+,2Au3++3Fe===2Au+3Fe2+
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作红色涂料 用作制造铜盐的原料
21.(16分)有一包含碳酸钠杂质的碳酸氢钠样品。为了测定其纯度,某校课外学习小组在实验室做如下实验:
(1)第一组同学称取样品m g置于坩埚中加热至恒重,根据质量减少来计算其纯度。
①为完成测定,以下图示中还缺少的仪器名称是________。
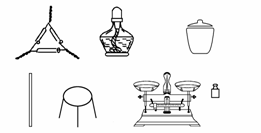
②为了减少实验误差,在加热至恒重的过程中应如何操作?
③若坩埚质量为m0。恒重后坩埚和残留物质量为m2 g,则计算碳酸氢钠样品纯度的计算式为w(NaHCO3)=________×100%。
(2)第二组同学称取样品m g,设计了如下图所示的装置:
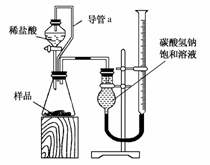
①装置中导管a的作用是___________________________________________
______________________________________________________________________。
②实验结束时,该组同学在测量实验中生成气体体积时应注意哪些问题?
③第二组同学在实验中准确测得3个数据:实验前样品的质量m g,实验前后量液管中液面读数分别为V1 mL、V2 mL,由于欲计算碳酸氢钠样品纯度时发现少了一个必须的物理量是________。
(3)分析上述两组实验方案,你认为哪组实验方案的误差会小些?为什么?
(4)请你设计一种除上述实验原理以外的方案,写出反应方程式并简述实验步骤。
解析:第一组同学利用碳酸氢钠受热易分解而碳酸钠受热不易分解的性质进行实验,灼烧样品所需的坩埚在取用时要用坩埚钳,为了减少实验误差,需要把灼烧后的样品放在干燥器中干燥;根据差量法即可求出碳酸氢钠的质量分数。第二组同学的实验依据碳酸钠和碳酸氢钠都和稀盐酸反应放出二氧化碳气体,通过气体的体积和样品的质量求碳酸氢钠的质量分数,因为实验环节少,所以误差也小。
答案:(1)①坩埚钳、干燥器
②加热后,放干燥器中冷却至室温后称置。重复操作,直到两次称量的质量差小于0.1 g。
③×100%
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,使分液漏斗中的稀盐酸能顺利滴下;滴入锥形瓶的稀盐酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀盐酸引起的二氧化碳气体体积误差
②待实验装置冷却后,上下移动量液管,使其中液面与广口瓶中液面相平;再将视线与量液管内的凹液面最低处相平来读取液体体积,即得到CO2在该状况时的体积。
③该条件下的气体摩尔体积
(3)第二组较好。实验系统中样品损耗几率低、反应转化率高;用精密测量仪器测定的数据误差较小。
(4)如沉淀法 BaCl2+Na2CO3===BaCO3↓+2BaCl2
步聚:取样称量、溶解、沉淀、过滤、洗涤、干燥、称量、计算。(其他合理方法也可,如滴定法等)
20.(10分)(2009·江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保持理念的是________(填字母)。
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)===Cu2+(aq)+H2(g);
ΔH=64.39 kJ·mol-1
2H2O2(l)===2H2O(l)+O2(g);ΔH=-196.46 kJ·mol-1
H2(g)+O2(g)===H2O(l);ΔH=-285.84 kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为________________________________________________________________________。
(3)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因 是________________________________________________________________________
________________________________________________________________________。
(4)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是__________________________________________
______________________________________________________________________。
解析:溶解Cu的化学方程式:Cu+2H++H2O2===Cu2++2H2O,由盖斯定律可得Cu(s)+2H+(aq)+H2O2(l)===Cu2+(aq)+2H2O(l);ΔH=64.39 kJ·mol-1+(-196.46 kJ·mol-1×)+(-285.84 kJ·mol-1)=-319.68 kJ·mol-1,第(3)问中Cu的溶解速率在温度较高时随温度升高,其溶解速率反而减小,主要原因是温度偏高时,H2O2分解速率加快而导致H2O2浓度变小影响反应速率;第(4)问中Cu元素由+2价变化至+1价,是利用了SO的还原性。
答案:(1)B、D
(2)Cu(s)+2H+(aq)+H2O2(l)===Cu2+(aq)+2H2O(l);
ΔH=-319.68 kJ·mol-1
(3)H2O2的分解速率加快
(4)2Cu2++SO+2Cl-+H2O2CuCl↓+SO+2H+
19.(8分)(2009·巢湖模拟)如图A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
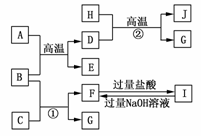
根据图示回答问题:
(1)写出下列物质的化学式:A________,B________,E________,I________;
(2)反应①的离子方程式是____________________________;
反应②的化学方程式是________________________________;
(3)J与盐酸反应的化学方程式是____________________________;
反应后的溶液与D反应的离子方程式是___________________________________。
解析:B为地壳中含量最高的金属元素,故B为Al。
由单质铝+B单质D+E可知该反应为铝热反应;
则A为Fe2O3,D为Fe,E为Al2O3。
根据铁与无色液体(H2O)在高温下反应可生成气体G和磁性材料J知该反应方程式表示为:
3Fe+4H2O(g)Fe3O4+4H2
即J为Fe3O4,G为H2。
由反应①及F与I的转化条件判断,C为强碱溶液,
F为NaAlO2,I为AlCl3。
答案:(1)Fe2O3 Al Al2O3 AlCl3
(2)2Al+2OH-+2H2O===2AlO+3H2↑
3Fe+4H2O(g)Fe3O4+4H2
(3)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
2Fe3++Fe===3Fe2+
18.等质量的三份铁a、b、c,分别加入足量的等量稀H2SO4中,a中同时加入适量CuSO4溶液,c中加入适量CH3COOK。下列各图中表示产生氢气总体积(V)与时间(t)的关系,其中可能正确的是 ( )
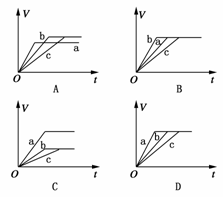
解析:铁与足量的稀H2SO4反应时,加入适量CuSO4溶液可形成铁铜原电池,加快铁与H2SO4的反应速率,但由于部分铁与CuSO4反应使得生成气体的量减少。加入适量CH3COOK,H2SO4与CH3COOK反应生成CH3COOH,CH3COOH为弱酸,使得铁与酸的反应速率减慢,由于酸过量,所以b和c产生的气体体积相等,A正确。
答案:A
第Ⅱ卷(非选择题,共46分)
17.(2009·山东英雄山中学高三第一学期期中测试)硒被称为主宰生命的元素之一,人们研究开发了一种含有钙、铁、锌、硒的保健品。对此下列对法正确的是 ( )
A.四种元素均处于第四周期,且均是主族元素
B.H2Se比H2O热稳定性好
C.单质钙能从FeSO4溶液中置换出铁
D.保健品为人体提供了必需的Fe、Zn、Se等微量元素
答案:D
16.下列反应的离子方程式正确的是 ( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
答案:B
15.下列化学反应中,水既不是氧化剂又不是还原剂的是 ( )
A.2Na2O2+2H2O===4NaOH+O2↑
B.2F2+2H2O===4HF+O2
C.2Na+2H2O===2NaOH+H2↑
D.NaH+H2O===NaOH+H2↑
答案:A
14.(2009·东北师大附中模拟)如图B为常见金属或非金属单质,有下列转化关系:
→\x(B――→,\s\up7(O2
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是 ( )
A.NaCl B.AlCl3
C.H2O2 D.KCl
答案:A
13.将4 g铝铁合金粉末溶于足量盐酸中,加入过量氢氧化钠溶液,过滤后向滤液中通入足量二氧化碳,再将沉淀滤出,经洗涤、干燥、灼烧后得到固体粉末的质量仍为4 g,原合金中铁的质量分数最接近 ( )
A.30% B.47%
C.53% D.70%
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com