
题目列表(包括答案和解析)
22.某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入 5 mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:

①写出H2O2反应的化学方程式:__________________;②实验结果说明催化剂作用的大小与__________有关。
(2)取三份含有等量H2O2、但质量分数不同的双氧水,分别向其中加入 1 g MnO2粉末。测定结果如下,请简要说明:
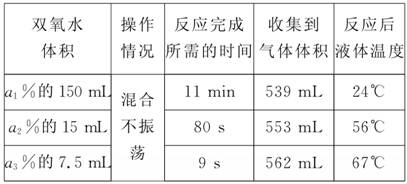
①反应完成所需的时间不同的原因:________________;②反应后液体温度不同的原因:____________________;
③收集到气体体积不同的原因:______________。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式:____________________________;
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对(简要文字说明):________________________________________________。
解析:(1)过氧化氢在二氧化锰做催化剂条件下反应的方程式为2H2O22H2O+O2↑,由于催化剂的表面积不同,所以反应的速率不同,产生气体的量不同。(2)相同质量的过氧化氢与相同状态的MnO2粉末作用,由于反应物浓度不同、液体温度不同,所以反应的速率不同,浓度越大,温度越高反应所需时间越短,由于反应中液体的量不同,故反应后液体温度不同;由于液体的量不同、液体的温度不同,影响气体在溶液中的溶解量,故反应后产生的气体的量不同。(3)H2O2的电离方程式为H2O2HO+H+,含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去,在褪色后的溶液中再加入NaOH溶液,若红色恢复说明甲对,若红色不恢复,则说明乙对。
答案:(1)①2H2O22H2O+O2↑
②催化剂的表面积(聚集状态)
(2)①溶质质量分数不同,液体温度不同
②反应放热相同,但液体的量不同
③液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
(3)①H2O2HO+H+
②在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢复则说明乙对
21.硫酸具有以下A-F的性质:A.酸性 B.高沸点难挥发 C.吸水性 D.脱水性 E.强氧化性 F.溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为____________。实验中往往有大量白色固体析出,可见浓硫酸在该实验中表现了哪些性质:____________。(浓硫酸性质用A、B、C、D、E、F填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为__________________________________。硫酸在该反应中表现了哪些性质:____________________________。
(3)在过氧化氢跟稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式:____________。与(2)中反应比较反应条件不同的原因是____________。
(4)蔗糖晶体中滴2-3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。写出产生有刺激气味气体的化学方程式:____________________________。该实验中浓硫酸表现的性质有____________________。
(5)工业制备CuSO4溶液采用实验(2)的原理而没有采用实验(1)和(3)的原理,是因为(1)和(3)有某些缺点,请你列举(1)和(3)分别有哪此缺点:实验(1)____________________________;实验(3)____________________________。
解析:(1)浓硫酸有强氧化性,与铜共热的化学方程式为2H2SO4(浓)+CuCuSO4+SO2↑+2H2O,反应中硫元素化合价由+6价降低到+4价,硫酸表现了氧化性,同时,硫酸有一部分化合价未改变,表现出了酸性,浓硫酸吸收了反应生成的水,使反应中有大量白色固体出现,表现了吸水性。(2)废铜屑倒入热的稀H2SO4中并通入空气制备CuSO4溶液的反应方程式为2Cu+O2+2H2SO42CuSO4+2H2O,硫酸表现出了强酸性。(3)过氧化氢有强氧化性,在常温下跟稀硫酸的混合溶液中加入铜片的反应方程式为Cu+H2O2+H2SO4===CuSO4+2H2O,由此可证明过氧化氢的氧化性大于氧气。(4)蔗糖中滴加几滴浓硫酸,会产生有刺激性气味的气体,且产生疏松多孔的黑色物质,说明浓硫酸有脱水性、吸水性、强氧化性,同时,浓硫酸溶于水会放出大量的热,反应的方程式为2H2SO4(浓)+CCO2↑+2SO2↑+2H2O。(5)工业制备硫酸铜主要从成本和污染两方面考虑,实验(1)生成的SO2污染环境,且硫酸的利用率低;实验(3)增加了成本,经济效益低。
答案:(1)2H2SO4(浓)+CuCuSO4+SO2↑+2H2O ACE
(2)2Cu+O2+2H2SO42CuSO4+2H2O A
(3)Cu+H2O2+H2SO4===CuSO4+2H2O 过氧化氢的氧化性比氧气强
(4)2H2SO4(浓)+CCO2↑+2SO2↑+2H2O CDEF
(5)制备CuSO4时产生的SO2污染环境,且硫酸的利用率低 原料成本高,经济效益低
20.饮用水质量是关系人类健康的重要问题。
(1)氯气是最早用于饮用水消毒的物质,其消毒作用主要是氯气溶于水后生成了次氯酸,该反应的离子方程式为____________,所生成的次氯酸的电子式为____________。
(2)写出工业上制取漂白粉的化学反应方程式:____________。
(3)ClO2被称为“第四代”饮用水杀虫剂,因其高效率,无污染而被广泛使用。制备ClO2是发达国家普遍重视的课题,我国北京永利科技有限公司已用电解法批量生产ClO2。其反应原理为:4ClO+4H+===4ClO2+O2↑+2H2O,试写出两电极反应式,阳极:____________;阴极:____________。
(4)相同物质的量的氯气与二氧化氯消毒时转移电子数目之比是____________。
(5)采用氧的一种同素异形体给自来水消毒,既提高了消毒效率、安全无副作用,又因为该物质在自然界中存在,对地球生命体起保护伞作用,该物质和氯气溶于水以及SO2的漂白原理分别是____________;____________。若将氯气与SO2二者混合,若想使石蕊试液褪色则范围为____________。
解析:(1)氯气与水反应的离子方程式为Cl2+H2O===H++Cl-+HClO。(2)漂白粉的主要成分为CaCl2和Ca(ClO)2,制取漂白粉是利用氯气与碱反应的性质,反应的方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。(3)阳极发生氧化反应,电极反应式为2H2O-4e-===O2↑+4H+;阴极发生还原反应,电极反应式为4ClO+4e-+8H+===4ClO2↑+2H2O。(4)1 mol Cl2消毒时转移电子为2 mol,1 mol 二氧化氯消毒时转移电子为5 mol,二者转移电子数之比为2∶5。(5)根据题中信息,氧气的同素异形体为臭氧,臭氧与氯气的漂白原理都是利用了其强氧化性;将有机色素氧化,漂白后不可恢复,SO2漂白是利用其与有色物质直接化合,生成不稳定的无色物质,褪色后在一定条件下又能恢复为原来的颜色;氯气与SO2混合,发生的反应为Cl2+SO2+2H2O===H2SO4+2HCl,若二者等物质的量混合,生成物无漂白性,若要使石蕊试液褪色,则>1。
答案:(1)Cl2+H2O===H++Cl-+HClO
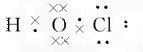
(2)2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(3)2H2O-4e-===O2↑+4H+ 4ClO+4e-+8H+===4ClO2↑+2H2O
(4)2∶5
(5)强氧化性 强氧化性 化合反应 >1
19.氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
A.(CN)2+2NaOH===NaCN+NaCNO+H2O
B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O
C.I2+2KCN===2KI+(CN)2
D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2
(4)处理CN-的工业废水常用ClO-氧化处理生成CNO-,反应的离子方程式如下:
aCN-+bClO-+2cOH-===dCNO-+eN2+fCO+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题。
①方程式中e∶f的值为____________;
A.1 B.1/2
C.2 D.不能确定
②若d=e=1,则b=____________。
解析:(1)HCN分子中含有4个共价键,则HCN的结构式为H-C≡N。(2)KCN是强碱弱酸盐,水解呈碱性,其水解方程式为CN-+H2O===HCN+OH-。(3)氰的氧化性比溴弱、比碘强,所以碘单质不能氧化KCN而制备(CN)2,C项错误;一种氧化剂与不同还原剂反应时,先氧化还原性强的物质,所以,加入少量的氯气,应先氧化KCN,Cl2+2KCN===2KCl+(CN)2,D项错误。(4)根据氢原子守恒,c=1;根据N原子守恒,2e+d=a,根据C原子守恒,d+f=a,则可知f=2e,e∶f=1∶2;若d=e=1,根据O原子守恒,2c+b=d+3f+c,代入数值,则b=6。
答案:(1)H-C≡N
(2)CN-+H2O===HCN+OH-
(3)CD
(4)B 6
18.已知BrCl能发生下列反应:nBrCl+2M===MCln+MBrn(M为+n价的金属元素),BrCl+H2O===HCl+HBrO,以下推论不正确的是( )
A.BrCl具有和卤素单质相似的化学性质
B.BrCl和M反应时,BrCl只做氧化剂
C.BrCl和NaOH溶液反应生成NaCl、NaBrO两种盐
D.将BrCl跟FeSO4溶液反应,溶液会变成无色
解析:根据题中信息,BrCl能与金属、水反应,其性质与卤素的单质相似,A项正确;BrCl和M反应时,Br元素化合价降低,Cl元素化合价不变,BrCl只做氧化剂,B项正确;BrCl+2NaOH===NaCl+NaBrO+H2O,C项正确;BrCl的氧化性介于氯与溴之间,跟FeSO4溶液反应,会把Fe2+氧化成Fe3+,D项错误。
答案:D
第Ⅱ卷(非选择题,共46分)
17.在氯水中存在多种分子和离子,可通过实验的方法加以确定,下列说法中可能错误的是( )
A.加入含有NaOH的酚酞试液,红色褪去,说明有H+存在
B.加入有色布条后,有色布条褪色,说明有HClO分子存在
C.氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
解析:氯气溶于水,且与水发生反应,氯水的成分呈现多样性,加入含有NaOH的酚酞试液,红色褪去,可能是氯水中的H+恰好与OH-中和,也可能是HClO漂白,A项错误;HClO有强氧化性,可使有色布条褪色,B项正确;氯水中因含有Cl2分子而呈浅黄色,C项正确;氯水中含有Cl-,与硝酸酸化的AgNO3溶液反应产生白色沉淀,D项正确。
答案:A
16.某化学教师为“氯气与金属钠反应”设计了如图装置与操作以替代相关的教材上的实验。实验操作:先给钠预热,当钠熔成圆球时,撤火、通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是( )
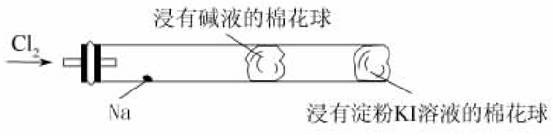
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收
解析:钠燃烧的火焰呈黄色,A项错误;氯气与钠反应生成大量的白烟,产物为氯化钠,B项正确;氯气是一种有毒的气体,实验中要考虑其污染,用碱液可吸收多余的氯气,C项正确;氯气与淀粉KI溶液反应生成的I2会使溶液变蓝,可用此现象检验氯气是否吸收完全,D项正确。
答案:A
15.(2009·吉林七校)向含有下列离子的溶液中,通入适量的氯气会引起离子浓度减少的是( )
①HCO ②SO ③OH- ④Fe2+
A.①② B.③④
C.①②③ D.①②③④
解析:氯气通入溶液中形成氯水,HCO与其中的H+反应而使其减少;氯气具有强氧化性,可将SO氧化为SO而使其减少;氯水中含有的H+会中和OH-而使其减少;Fe2+会被氧化成Fe3+而使其减少。
答案:D
14.(2009·江苏盐城中学)工业上以硫铁矿为原料制硫酸所产生的尾气中含有SO2,为便于监控,实施环境保护,下列适合测定硫酸尾气中SO2含量的试剂是( )
A.品红溶液 B.氨水、酚酞试液
C.碘水、淀粉溶液 D.以上都可以
解析:品红不能精确测定硫酸中SO2的含量,A项错误;氨水会与硫酸反应,使测量结果误差较大,B项错误;碘水与SO2反应生成I-,可根据淀粉溶液变化情况,测量SO2的含量,C项正确。
答案:C
13.(2009·华师大一附中)实验室有一瓶久置的白色K2SO3粉末,元素分析表明粉末中K和S元素的质量比为39∶16,下列结论正确的是( )
A.根据元素分析结果推测该粉末为纯净物
B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4
C.将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3
D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物
解析:亚硫酸钾具有还原性,易被空气氧化为K2SO4,K2SO3与K2SO4中K和S元素的质量比都为39∶16,故从元素分析结果中不能确定该粉末为纯净物,A项错误;K2SO3与K2SO4都会与氯化钡反应生成白色沉淀,故加入氯化钡也不能证明原粉末中含有K2SO4,B项错误;粉末与盐酸反应产生气泡,只能证明粉末中含有K2SO3,但不能确认其是否变质,C项错误;加入过量盐酸,有气体生成,证明粉末中含有K2SO3,且同时加入氯化钡有白色沉淀生成,证明粉末中含有K2SO4,D项正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com