
题目列表(包括答案和解析)
4.下列有关铁元素的叙述中正确的是( )
A.氢氧化铁可以由相关物质通过化合反应而制得
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O
D.铁元素位于周期表的第4周期 ⅧB族
解析:利用反应4Fe(OH)2+O2+2H2O===4Fe(OH)3可制取氢氧化铁,所以A项正确;卤素单质的氧化性随其原子序数的增加而减弱,I2与Fe反应的生成物为FeI2,即Fe3+的氧化性大于I2的氧化性,因此Fe3+可氧化I-,则B、C项错误;铁元素位于元素周期表的第4周期Ⅷ族,D项错误。
答案:A
3.向100 mL 0.25 mol/L 的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45 g B.2.3 g C.1.15 g D.0.575 g
解析:由题意可知,Na与AlCl3恰好完全反应,AlCl3的物质的量为 0.025 mol,根据Al元素守恒,计算得NaAlO2的物质的量为 0.025 mol;由Cl元素守恒,得NaCl的物质的量为 0.075 mol,则生成物中钠元素的物质的量为 0.1 mol,所以加入金属钠的质量为2.3 g。
答案:B
2.下列化合物中,不能通过化合反应而得到的是( )
①SO3 ②Fe(OH)3 ③H2SiO3 ④NaHCO3 ⑤FeCl2
A.③ B.①③ C.①⑤ D.②③
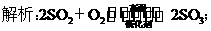
4Fe(OH)2+O2+2H2O===4Fe(OH)3;
Na2CO3+CO2+H2O===2NaHCO3;
2FeCl3+Fe===3FeCl2;硅酸不能。
答案:A
1.红珊瑚栖息于200-2000 m的海域,产于台湾海峡、南中国海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥的象征,一直用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,其红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Si D.Cu
解析:根据平常对各元素的化合物性质的了解得知,铁的化合物多数有颜色,红色的比较多。
答案:B
22.(2010·名校联考)(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)常温下,0.1 mol/L的醋酸和pH=1的醋酸各100 mL,分别与足量的锌粒反应,产生的气体前者比后者__________。
(3)在25 ℃条件下将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为(填选项字母,下同)__________。
A.5 B.7
C.3-5之间 D.5-7之间
(4)25 ℃时,向0.1 mol/L的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液pH将__________。
A.增大 B.减小
C.不变 D.无法确定
(5)室温下,向0.1 mol/L的H2SO4中加入足量的锌粒,若想减慢H2产生的速率,但又不影响H2的体积,可以向硫酸溶液中加入__________试剂。
A.碳酸钠晶体
B.醋酸钠晶体
C.滴加少量硫酸铜溶液
D.水
解析:(1)醋酸、盐酸均是一元酸,体积、浓度均相等,则提供等量H+,产生气体相等。
(2)醋酸是弱酸,pH=1的醋酸浓度要远大于0.1 mol/L,故等体积时与足量Zn反应,pH=1的醋酸产生气体多。
(3)pH=5的氯化铵溶液稀释100倍后,浓度变小,水解程度增大,因此H+浓度小于10-5而大于10-7,即选D。
(4)加入醋酸钠晶体,使醋酸电离平衡向逆向移动,H+浓度减小,故pH增大。
(5)减慢H2产生速率,但不影响产生H2的体积,则可减小H+浓度,但不减少H+物质的量,故选B、D。
答案:(1)= (2)少 (3)D (4)A (5)BD
21.(1)现有0.1 mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是______________________________________________________。纯碱溶液呈碱性的原因(用离子方程式表示)是__________________________________________________________,你认为该溶液pH的范围一定介于__________之间。
(2)为探究纯碱溶液呈碱性是由CO引起的,请你设计一个简单的实验方案。
________________________________________________________________________________________________________________________。
解析:纯碱由于水解而使溶液显碱性,水解程度较小,所以其pH应小于同浓度的一元强碱的pH。要证明碱性与CO有关,可以用化学反应将CO除去,对比反应前后溶液的酸碱性即可。
答案:(1)把一小块pH试纸放在表面皿(或玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的pH CO+H2O HCO+OH- 7-13
HCO+OH- 7-13
(2)向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱溶液呈碱性是由CO引起的
0.2 mol/LHCl溶液中c(H+)=0.2 mol/L,由水电离产生c(H+)=c(OH-)==5×10-14 mol/L。
(2)0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合后,MOH与MCl物质的量相等,混合后溶液pH<7,说明M+水解趋势大于MOH电离趋势。
(3)pH=3的HR溶液c(H+)=10-3 mol/L,pH=11的NaOH溶液中c(OH-)=10-3 mol/L。因HR与NaOH等体积混合后pH≠7,故HR一定为弱酸,酸过量,故pH<7。
答案:(1)> (2)< (3)<7
20.(1)常温下将0.2 mol/LHCl溶液与0.2 mol/LMOH溶液等体积混合,测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)__________0.2 mol/LHCl溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(2)常温下若将0.2 mol/LMOH溶液与0.1 mol/LHCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度__________MCl的水解程度。(填“>”“<”或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH__________。(填“>7”“<7”或“无法确定”)
解析:(1)由反应后溶液pH=6知MOH为弱碱,故反应后的溶液pH=6为M+水解产生的,由水电离产生c(H+)=10-6 mol/L。
19.若用浓度为0.20 mol/L的标准盐酸滴定氢氧化钠溶液,再用此氢氧化钠溶液滴定未知浓度的盐酸,滴定时记录了以下2组数据:

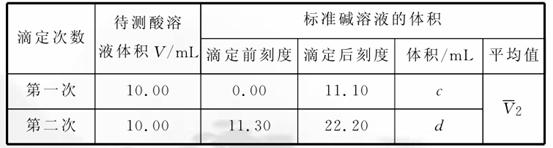
完成实验记录:
(1)a=________、b=________、1=__________。
(2)c=________、d=________、2=__________。
(3)由以上数据算出碱液浓度为__________mol/L,酸液浓度为__________mol/L。
解析:c(NaOH)=
=
=0.21 mol/L
c(HCl)=
==0.23 mol/L
答案:(1)10.40 10.60 10.50
(2)11.10 10.90 11.00
(3)0.21 0.23
18.(2010·石家庄质量检测)用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A.20 mL 2 mol/L FeCl3溶液
B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液
D.40 mL 2 mol/L NH4HCO3溶液
解析:D选项加热蒸干后固体完全分解。C选项加热蒸干灼烧后相当于0.02 mol Na2SO4,质量为2.84 g。B选项加热蒸干后为0.02 mol Na2CO3,质量为2.12 g,A选项加热蒸干后为0.02 mol Fe2O3,质量为3.2 g。
答案:A
第Ⅱ卷(非选择题,共46分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com