
题目列表(包括答案和解析)
8.(1)分别写出由氧气在一定条件下生成下列物质的化学方程式(注明反应条件):
①O3:_______________________________________________________________________。
②Na2O2:______________________________________________________________________。
③Na2O:______________________________________________________________________。
(2)指出氧元素在下列各物质中的化合价:
O3____________________;K2O2__________________;Na2O__________________________。
(3)RbO2也能吸收CO2放出氧气,其化学方程式是__________________________________。
(4)人体内O-2(超氧离子)对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
 O-2+
O-2+  H2O
H2O
 H2O2+
H2O2+ O2↑+
O2↑+

解析:本题(1)(2)两小题属基础题,较易解答。(3)小题可依据过氧化钠与CO2反应生成Na2CO3和O2进行知识类比,推导出RbO2和CO2反应的化学方程式。(4)小题可依据质量守恒和电荷守恒确定未知生成物为OH-。
答案:①3O2 2O3
2O3
②2Na+O2 Na2O2
Na2O2
③4Na+O2 2Na2O
2Na2O
(2)0 -1 -2
(3)4RbO2+2CO2====2Rb2CO3+3O2
(4)2 2 1 1 2 OH-
7.(2010山东临沂高三模拟)钡和钠相似,也能形成含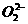 的过氧化物,下列叙述中不正确的是( )
的过氧化物,下列叙述中不正确的是( )
A.过氧化钡的化学式是BaO2
B.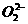 的电子式是[
的电子式是[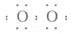 ]2-
]2-
C.1 mol Na2O2或BaO2跟足量的水反应都生成0.5 mol O2
D.过氧化钠和过氧化钡都是强氧化剂
解析:BaO2可由Na2O2来类推,2BaO2+2H2O2Ba(OH)2+O2↑,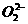 的电子式为[
的电子式为[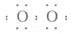 ]2-,故选B。
]2-,故选B。
答案:B
6.(2010潍坊模拟)质量分数相等的Na2CO3和NaHCO3的混合物x g,加热一段时间后质量变为y g,当NaHCO3完全分解时,y值等于( )
A.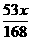 B.
B.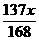 C.
C.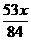 D.
D.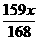
解析:解题关键找出前后混合物中相同的部分得出差量,结合方程式求解。
2NaHCO3 Na2CO3+H2O+CO2↑
固体减轻
Na2CO3+H2O+CO2↑
固体减轻
2×84 106 62
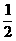 x g m
g
(x-y) g
x g m
g
(x-y) g
m=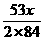
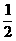 x-
x-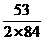 x=x-y
x=x-y
y=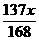
答案:B
5.已知锂及其化合物的许多性质与其他碱金属差异很大,却与镁相似。下面有关锂及其化合物性质的叙述不正确的是( )
A.碳酸锂的溶解度比碳酸氢锂的小
B.碳酸锂受热很难分解
C.锂在过量氧气中燃烧主要生成的是氧化锂而不是过氧化锂
D.锂可以与N2化合生成氮化锂(Li3N)
解析:本题考查锂的特殊性及学生的知识迁移能力。关键是把握住锂及其化合物的许多性质与其他碱金属差异很大,却与镁相似这一关键词。已知Mg(HCO3)2溶解度比MgCO3大,故LiHCO3的溶解度大于Li2CO3;因MgCO3受热易分解,故Li2CO3受热易分解;Mg在O2中燃烧生成MgO,Li与Mg相似,故在O2中燃烧主要生成Li2O,另外含有极少量的Li2O2;因Mg与N2可直接化合,故Li与N2可直接化合。选B。
答案:B
4.钠和钾化学性质相似的根本原因是( )
A.都是碱金属 B.都与酸反应
C.都与水反应生成碱 D.原子的最外层都只有一个电子
解析:碱金属在原子结构上的相似性,决定其化学性质相似。
答案:D
3.(2010湖北黄冈检测)一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,用时将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间。以下关于其制冷原因的推测肯定错误的是( )
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生的复分解反应是吸热反应
D.NH4NO3溶于水会吸收热量
解析:没有复分解反应发生。
答案:C
2.下列对碱金属性质的叙述不正确的是( )
A.单质都是银白色的柔软金属,密度都较小
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水剧烈反应生成碱和氢气
D.单质的熔沸点随着原子序数的增加而降低
解析:单质在空气中燃烧不一定生成过氧化物,如锂生成氧化锂。单质的熔沸点随着原子序数的增加而降低。
答案:B
1.下列物质性质的比较,正确的是( )
A.热稳定性:Na2CO3>NaHCO3>H2CO3 B.熔点:K>Na>Li
C.溶解度:NaHCO3>Na2CO3 D.氧化性:Li+<Na+<K+
解析:热稳定性规律M2CO3>MHCO3>H2CO3,A正确。碱金属单质随核电荷数递增,熔沸点逐渐降低,还原性逐渐增强,对应离子的氧化性逐渐减弱,因此B、D不正确。Na2CO3的溶解度大于NaHCO3。
答案:A
0.1
L ·a mol·L-1=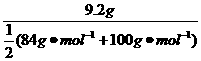 a=1 mol·L-1;若盐酸不足,则a<1 mol·L-1,产生的CO2的体积按HCl的物质的量计算:V(CO2)=2.24a L;若盐酸过量,则a>1 mol·L-1产生的CO2的物质的量等于混合物的物质的量,V(CO2)=2.24 L。
a=1 mol·L-1;若盐酸不足,则a<1 mol·L-1,产生的CO2的体积按HCl的物质的量计算:V(CO2)=2.24a L;若盐酸过量,则a>1 mol·L-1产生的CO2的物质的量等于混合物的物质的量,V(CO2)=2.24 L。
(3)盐酸足量,混合物完全反应。若9.2 g全部为NaHCO3,则产生的CO2体积:V(CO2)=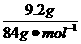 ×22.4 L·mol-1=2.45 L;若9.2 g全部为KHCO3,则产生的CO2体积:V(CO2)=
×22.4 L·mol-1=2.45 L;若9.2 g全部为KHCO3,则产生的CO2体积:V(CO2)=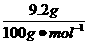 ×22.4 L·mol-1=2.06 L。若9.2 g为两者混合物时,则有:2.06
L<V(CO2)<2.45 L。
×22.4 L·mol-1=2.06 L。若9.2 g为两者混合物时,则有:2.06
L<V(CO2)<2.45 L。
答案:(1)a mol·L-1 (2)2.24a L 2.24 L 2.24 L (3)2.06 L<V(CO2)<2.45 L
11.等物质的量的NaHCO3和KHCO3的混合物9.20 g与100 mL盐酸反应。
(1)试分析,欲求标准状况下生成的CO2的体积时,还需什么数据(用a、b等表示,要注明单位)。
(2)求标准状况下生成的CO2的体积。
|
所需数据的取值范围 |
生成CO2的体积(标准状况) |
|
盐酸不足时 |
|
|
盐酸恰好反应时 |
|
|
盐酸过量时 |
|
(3)若NaHCO3和KHCO3不是等物质的量混合,则9.20 g固体与盐酸完全反应时,在标准状况下生成CO2气体的体积范围___________________________。
解析:(1)由H++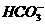 ====H2O+CO2↑可知,欲求标准状况下的CO2气体的体积,需确定
====H2O+CO2↑可知,欲求标准状况下的CO2气体的体积,需确定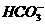 与H+过量与否,显然缺少的数据为盐酸的物质的量浓度,设为a mol·L-1。
与H+过量与否,显然缺少的数据为盐酸的物质的量浓度,设为a mol·L-1。
(2)当H+与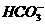 恰好完全反应时:
恰好完全反应时:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com