
题目列表(包括答案和解析)
5. 为了避免青铜器生成铜绿,以下方法正确的是( )
A.将青铜器放在银质托盘上
B.将青铜器保存在干燥的环境中
C.将青铜器保存在潮湿的空气中
D.在青铜器的表面覆盖一层透气的高分子膜
4. (2007年高考广东卷)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH--2e-=2H2O
B.O2+4H++4e-=2H2O
C.H2-2e-=2H+
D.O2+2H2O+4e-=4OH-
3. 某原电池总反应离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池是 ( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3溶液
B.正极为Cu,负极为Fe,电解质溶液为Fe(NO3)2溶液
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
2. 下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是 ( )
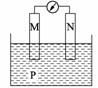
|
|
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸溶液 |
|
B |
铜 |
铁 |
稀盐酸 |
|
C |
银 |
锌 |
硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁容易 |
A 锌铜稀硫酸溶液
B铜铁稀盐酸
C银锌硝酸银溶液
D锌铁硝酸铁溶液
1. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是 ( )
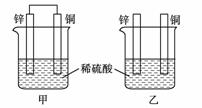
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速率甲比乙慢
17. t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g)  xC(g)
xC(g)
2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡的状态,生成C的平均反应速率为 。
(2)x= ;
(3)若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A.向正反应方向移动
B.向逆反应方向移动
C.平衡不移动
(4)若向原始平衡混合物的容器中再充入a mol C,在t ℃时达到新平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到C的物质的量分数与原平衡相等,起始加入的三种物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
16. 接触法制硫酸的核心反应是2SO2(g)+O2(g)  2SO3(g),ΔH<0。在2 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol O2,在一定温度下使其反应,反应至4 min时,O2的浓度为0.6 mol/L,当反应到8 min时,反应到达平衡,此时c(SO3)=a mol/L。
2SO3(g),ΔH<0。在2 L恒容的密闭容器中,加入3 mol SO3(g)和1 mol O2,在一定温度下使其反应,反应至4 min时,O2的浓度为0.6 mol/L,当反应到8 min时,反应到达平衡,此时c(SO3)=a mol/L。
(1)0 ~4 min内生成O2平均速率v(O2)= ;
(2)达到平衡时,c(O2)=c(SO2),则a= mol/L;
(3)若起始时n(SO3)、n(SO2)、n(O2)(/ mol)分别按下列4组数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol/L的是 。
A.1、2、2 B.3、1.5、1 C.3、0、0 D.0、6、5
(4)当上述反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 。(填字母)
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 G.移出氧气
15. (2009年高考江苏卷化学信息题)下图图1中P为一可自由滑动的活塞,K为容器A和B之间的旋塞。将K关闭,在A中充有1 mol X和1 mol Y,B中充有3 mol X和3 mol Y。起始时,V(A)=V(B)=1 L,在相同的温度和有催化剂存在的条件下,两容器中各自发生反应:X(g)+Y(g) 2Z(g)+W(g);ΔH<0。
2Z(g)+W(g);ΔH<0。
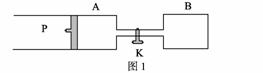
当达到平衡时,V(A)=1.25 L。问:
(1)A中Y的转化率为 ,A、B中Y的转化率的关系是α(A) α(B)(填“<”、“>”或“=”)。
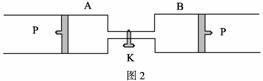
(2)如果将B端改装成与A端一致(如图2),将K关闭,达到平衡后,B的体积为 L,B中X的体积分数为 。
(3)如果将K打开,待反应达到平衡后,再同时等幅升高A、B的温度,达到新平衡后,A中活塞向左移动,其移动的原因是 。
14. 常温、常压下,A、B、C、D均为气态。A和B可发生可逆反应A+B C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达到平衡时C的浓度如下表:
C+nD。若2 mol A和2 mol B混合充入体积可变的密闭容器中,在不同条件下达到平衡时C的浓度如下表:
|
温度/℃ |
压强/Pa |
C平衡浓度/mol·L-1 |
|
25 |
1×105 |
1.0 |
|
25 |
2×105 |
1.8 |
|
25 |
4×105 |
3.2 |
|
25 |
5×105 |
6.0 |
(1)可逆反应中化学计量数n的取值范围是 ,理由是 。
(2)在5×105 Pa时,D的状态为 。
13. 在密闭容器中进行下列反应:CO2(g)+C(s)高温2CO(g);ΔH>0,达到平衡后,改变下列条件,则指定物质的浓度及平衡如何变化?
(1)增加C,平衡 ,c(CO) 。
(2)减小密闭容器体积,保持温度不变,则平衡 ,c(CO2) 。
(3)通入N2,保持密闭容器体积和温度不变,则平衡 ,c(CO2) 。
(4)保持密闭容器体积不变,升高温度,则平衡 ,c(CO) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com