
题目列表(包括答案和解析)
2.下列物质中与CH3-CH2-CH2-CH3互为同分异构体的是 ( )
A.CH3-CH3 B.CH3-CH2-CH3
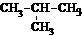
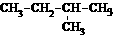
C. D.
1.若1 mol 某气态烃CxHy完全燃烧,需用2 mol O2,则此气态烃的分子式为 ( )
A.CH4 B.C2H4 C.C2H6 D.C3H8
11.某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、大理石、水。试回答:
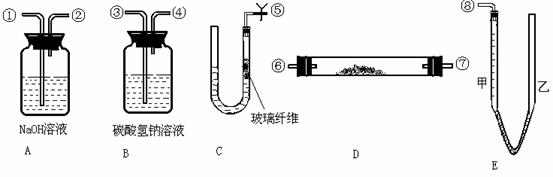
(1)图中装置的连接顺序是(填各接口的编号),其中连接胶管及夹持装置均省略:
______________________________________________。
(2)装置C中放入的反应物是________________和_____________。
(3)装置A的作用是_____________;装置B的作用是______________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意________和_______。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
答案:(1)⑤③④⑥⑦①②⑧(⑥⑦顺序可对调) (2)大理石 盐酸 (3)吸收混在O2中未反应的CO2;吸收CO2中混有的HC1 (4)a c
出题意图:利用我们学习过的知识来用到试验中来。
思路点拨:因为模拟呼吸面具的原理是通过过氧化钠与潮湿的CO2反应,制取O2并测量O2的体积,因此必须首先制取CO2,并进行必要的提纯,与Na2O2反应后还要提纯以保证测量出的O2的体积更准确。观察C装置,在U型管的一侧用玻璃纤维隔开,上边可以放置固体这显然是一个类似于启普发生器的装置,可用于制取CO2。由于Na2CO3易溶于水,用它制取CO2会使U型管失去随时开关的作用,因此必须选用大理石和盐酸(不能选用H2SO4,因CaSO4微溶于水,会使反应速率渐慢),而盐酸易挥发可用饱和NaHCO3溶液除去CO2中的HC1。在D中放置Na2O2,由于气体与固体物质反应是气体从固体表面过去时进行的,CO2不可能充分反应,剩余CO2会与O2一起逸出,为此需用NaOH溶液除去其中的CO2,然后再测量O2的体积。最后,还要清楚题中量气装置的作用原理,当一端(甲管)充入O2后,由于压强增大,甲管液面下降,乙管液面升高。二管液面的差即说明甲管中O2的压强较大,这时测量的O2的体积一定偏小,此时可以调节甲、乙两管的相互高度,使液面相平,这时甲管中的读数就是在相等压强下测得的较准确的体积。
10..恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2 (g) + 3 H2(g)= 2NH3(g) ⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值 ⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平移时NH3的物质的量。 ⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。 ⑷原混合气体中,a∶b = 。 ⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。 ⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
 答案:⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3
a = 13 + 3 =
16
解法二:N2
+ 3H2 2NH3
开始时 a b 0
t时13
6
答案:⑴解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉的N2的物质的量为x mol。则 x∶6 = 1∶2 解之x = 3
a = 13 + 3 =
16
解法二:N2
+ 3H2 2NH3
开始时 a b 0
t时13
6
在t时生成 6 mol NH3,消耗了3 mol N2,所以a = 13 + 3 = 16 ⑵n平(NH3) = 716.8L -1 ×25% = 32mol×25% = 8mol ⑶5∶4 ⑷2∶3 ⑸1∶2 ⑹ 3∶3∶2
出题意图:对化学平衡的实质的考察。
思路点拨:根据题目所给的信息,结合化学平衡的计算,利用常规的计算就可解答这道题目。
9.三位学生设计了下述三个方案,并都认为如果观察到的现象和自己设计的方案一致,即可证明某无色溶液中有SO42-; 。
方案1:试液----→BaCl2溶液白色沉淀----→足量HNO3沉淀不溶解
方案2:试液----→足量稀盐酸白色沉淀----→BaCl2溶液沉淀不溶解
方案3:试液----→足量HNO3白色沉淀----→Ba(NO3沉淀不溶解
试评价上述方案是否严密,并说明理由。
答案:方案1不严密,因为含Ag+而不含的无色溶液中也会出现此方案的现象。方案2严密,已经排除Ag+的存在,也排除了SO32-CO32-等阴离子的存在,只有SO42-的无色溶液才能出现此现象。方案3不严密,因为SO32-存在不含SO42-会出现此现象
命题意图:要求学生根据自己的能力来判断试验方案。
思路点拨:方案1不严密,因为含Ag+而不含的无色溶液中也会出现此方案的现象。方案2严密,已经排除Ag+的存在,也排除了SO32-CO32-等阴离子的存在,只有SO42-的无色溶液才能出现此现象。方案3不严密,因为SO32-存在不含SO42-会出现此现象。
8.某纯碱样品中只含有NaHCO3杂质,兴趣小组为了测定该样品中Na2CO3的纯度,设计了以下几种实验方案:
方案I:取一定量的样品配成溶液,滴加2滴酚酞,用c mol/LHCL溶液滴定至无色,用去HCl溶液的体积为V1mL;再滴加2滴甲基橙,继续用c mol/LHCl溶液滴定至橙色,又用去HCl溶液的体积为V2mL。用c、V1、V2计算出Na2CO3的纯度。
方案Ⅱ:称取m1 g样品溶于水,滴加过量BaCl2溶液,过滤,将所得BaCO3沉淀经洗涤、干燥后称得其质量为m2 g,用m l、m2计算出Na2CO3的纯度。
方案Ⅲ:称取m3g样品与足量稀H2SO4溶液反应,用排饱和碳酸氢钠溶液的方法测得生成的CO2的体积为V3 L(已折换成标准状况),用m3、V3计算出Na2CO3的纯度。
方案Ⅳ:称取m4g样品与足量稀H2SO4溶液反应,将生成的气体用碱石灰吸收,称量,
测得生成的CO2的质量为m5 g,用m4、m5计算出Na2CO3的纯度。
回答下列问题;
(1) 方案I中依次发生的反应的离子方程式是: 、
(2) 方案Ⅱ中,怎样检验加入的BaCl2溶液已过量,请简述操作方法:
(3) 方案Ⅲ和Ⅳ中都有CO2生成,不需要干燥就可测定CO2体积或质量的是方案. (填序号);若生成的CO2部分残留在反应容器中,会使实验结果产生误差的是方案 (填序号),此误差会使测得的Na2CO3的纯度 (填“偏大”或“偏小”)。
(4) 不用任何化学试剂(除样品外),请你再设计一个实验方案,测定该纯碱样品中Na2CO3的纯度
 命题意图:考察学生对试验的分析能力。
命题意图:考察学生对试验的分析能力。
思路点拨:本题是一个选择性试验,要求学生对题目的要求有个很深的认识。,对实验现象的考查,既可以是直接由实验现象得出正确的结论,也可以是将实验的方法与正确的结论联系起来进行设问。对实验结果的分析,一般要求考生分析实验的关键细节以及产生的误差等等。实验结果的处理,既可能直接报告数据。
7.将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是 ( )
A. 35.5a=(W2-W1) V2
B. n(Al)>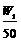 mol
mol
C. n(Na)+3n(Al)=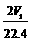 mol
D. aV2=
mol
D. aV2=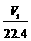
答案:C
命题意图:考察高中化学钠和铝有关化学性质。
思路点拨:本题是一道综合了钠和铝有关化学性质的较难的计算型选择题,题目融合了化学中的“初态--终态”思想以及在化学选择和计算题中普遍使用的守恒法。根据题意,W1 g的Na和Al经过和一定量的水反应,置换出了V1 L H2,由电子得失守恒知:Na和Al完全反应变成Na+和Al3+失去的电子数应该等于生成的H2得到的电子数,则有n(Na)+3n(Al)=2V1/22.4 ;且Al要完全溶解 ,必须使生成的n(NaOH)>n(Al),假设n(Al)=n(NaOH)=n(Na),则有23n(Na)+27n(Al)=W1,得n(Al)<W1/50 ;溶液经过一系列的反应最终得到的固体应该是NaCl和AlCl3的混合固体,因此,由“初态(Na和Al)--终态(NaCl和AlCl3)”知W2-W1是盐酸中Cl元素的质量,则有35.5aV2=W2-W1 ;aV2可看成是盐酸中Cl元素的物质的量,由Cl元素守恒知aV2=n(Na)+3n(Al)=2V1/22.4。
二 非选择题。
6. 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+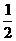 O2(g)===CO(g);△H=-393.5kJ/mol
O2(g)===CO(g);△H=-393.5kJ/mol
B.2H2(g)+O2(g)===2H2O(g) ;△H=+571.6kJ/mol
C.CH4(g)+2O2(g)=== CO2(g) +2H2O(g) ;△H=-890.3kJ/mol
D.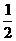 C6H12O6(s)+3O2(g)=== 3CO2(g) +3H2O(l) ;△H=-1400kJ/mol
C6H12O6(s)+3O2(g)=== 3CO2(g) +3H2O(l) ;△H=-1400kJ/mol
答案 D
命题意图:考察学生对化学反应中能量变化的理解,以及热化学方程式的书写。
思路点拨:本题错选大多为A、C,原因为未能正确理解燃烧热概念中生成稳定氧化物的含义,CO2是C的稳定氧化物,生成的H2O应该是液态的。
5.已知Co2O3在酸性溶液中被还原成Co2+,Co2O3、Cl2 、FeCl2 、I2 的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A、3Cl2 +6FeI2 =2FeCl3 +4FeI3 B 、Cl2 +FeI2 =FeCl2 +I2
C、Co2O3+6HCl=2CoCl2 +Cl2 +3H2O D、2Fe3+ +2I- =2Fe2++I2
答案 A
命题意图:考察氧化还原反应中的氧化性强弱的比较。
思路点拨:B错的原因是对Cl2 、Fe3+、I2 的氧化性很清楚,但没有注意当Cl2 少量时可以只氧化I-; C错是由于对Co2O3、Cl2 氧化性强弱不清楚,而认为此反应不能发生。
4.下列有关实验的叙述中,合理的是 ①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体 ③用托盘天平称量5.85 g NaCl固体配制100 mL 1 mol/LNaCl溶液 ④用稀硝酸洗涤做“银镜反应”实验后附着在试管壁上的银 ⑤向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体 ⑥实验室配制氯化亚锡溶液时,可先将氯化亚锡溶解在盐酸中,再加入蒸馏水稀释,最后加入少量锡粒
A.①②④ B.②⑧⑥ C.②④⑥ D.②③④⑤⑥
答案C
命题意图:考察对学生试验的掌握程度,要求掌握教材上的试验并能对试验原理和式样步骤有明确的认识。
思路点拨:①pH试纸只能大致的测定溶液的pH;③托盘天平称量只能精确到小数点后一位即5.8 g;⑤相当于在Fe(OH)3胶体中加入了电介质NaOH使胶体聚沉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com