
题目列表(包括答案和解析)
1.下列对硝酸的认识不正确的是( )
A.浓硝酸和稀硝酸都具有氧化性 B.铜和稀硝酸的反应属于置换反应
C.金属与硝酸反应一定不产生氢气 D.常温下可用铝或铁制品盛装浓硝酸
解析:硝酸是强氧化性酸,且浓硝酸的氧化性强于稀硝酸,A正确。由铜与浓、稀硝酸反应的方程式看,均不属于置换反应;因为硝酸是强氧化性酸,金属与硝酸反应均不生成H2,而生成水。D之所以正确,是由于浓硝酸可使铝和铁的表面生成一层致密的氧化膜,阻止反应进一步进行,但是在加热情况下,铝和铁可以与浓硝酸反应。
答案:B
1.66×102 mol m
m=4.98 kg
答案:(1)1.66×102 mol (2)4.98 kg
11.电闪雷鸣是日常生活中司空见惯的现象。设某次雷电中,两块云团间的电势差约为109 V,放电荷量约为15 C。在闪电过程中,空气中的氮气和氧气直接化合,已知每摩尔氧气和氮气化合要吸收180.74 kJ的能量,闪电时有千分之一的能量用于这一反应,那么:
(1)此次闪电所产生的NO的物质的量有多大?
(2)此次雷雨闪电的生成物相当于给土壤施了多少千克尿素?
解析:(1)由W=Uq=109 V×15 C=1.5×1010 J
由N2+O2====2NO
n(NO)=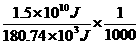 ×2 mol=1.66×102 mol
×2 mol=1.66×102 mol
(2)根据氮元素守恒:
2NO - CO(NH2)2
2 mol 60×10-3 kg
10.在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z。若已知:
①反应前的X与反应后生成的Z的物质的量之比n(X)∶n(Z)=2∶3。
②单质Y的分子为正四面体构型。
请填写下列空白。
(1)单质Y是______________,单质Z是_________________(填写名称或化学式)。
(2)Y分子中共含________________个共价键。
(3)X分解为Y和Z的化学方程式为:____________________________________。
解析:本题是一道推断题,解题关键是找出“突破口”,该题的突破口是单质Y的分子为正四面体构型。根据Y分子为正四面体构型,假设Y为P4,可推测X为PH3。
4PH3 P4+6H2
P4+6H2
即n(X)∶n(Z)=2∶3
答案:(1)P4 H2(2)6
(3)4PH3 P4+6H2
P4+6H2
9.GaAs是仅次于硅的一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。
(1)Ga和As的最外层电子数分别是_____________________________________________。
(2)GaAs中Ga和As的化合价分别是___________________________________________。
(3)第ⅣA族的C和Si也可以形成类似的化合物半导体材料,该化合物半导体材料的化学式可表示为__________________。
解析:由主族元素原子的最外层电子数等于它的族序数,可知Ga的最外层有3个电子,As最外层有5个电子。由于它们形成稳定化合物GaAs,其化合价分别为+3和-3。第ⅣA族的元素Si和C,最外层皆有4个电子,形成类似化合物的化学式为SiC。
答案:(1)3、5 (2)+3、-3 (3)SiC
8.(2010吉林长春高三测试)As2O3是一种白色粉末,其晶体在193 ℃升华,微溶于水。剧毒物质砒霜的主要成分是As2O3,可用于制造杀虫剂和灭鼠剂等。90年代末,我国医学工作者研制出用砒霜制成亚砷酸注射液治疗癌症的方法,已得到国际公认。以下有关As2O3的叙述正确的是( )
A.As2O3是砷酸(H3AsO4)的酸酐 B.As2O3的晶体为原子晶体
C.As2O3既能被氧化,又能被还原 D.砒霜制成亚砷酸注射液时发生了氧化还原反应
解析:H3AsO4的酸酐是As2O5,而不是As2O3,故A错。由已知条件As2O3晶体在193 ℃升华,可知其为分子晶体,故B错。由As2O3制成亚砷酸(H3AsO3)注射液时砷元素价态没有发生变化,所以为非氧化还原反应,故D错。又As2O3中As元素的价态为+3价,介于最低(-3)和最高(+5)价之间,所以As2O3既能被氧化,又能被还原。
答案:C
7.(2010山东烟台高三模拟)五氧化二磷不仅是一种强干燥剂,而且有很强的脱水性。向浓HNO3中加入过量的P2O5,能生成一种含氮的化合物M,则M最可能是( )
A.N2 B.NO2 C.NO D.N2O5
解析:根据化合价判断,P2O5具有很强的脱水性,反应后生成物中氮元素的化合价不发生变化,仍为+5价。
答案:D
6.关于磷的叙述中,正确的是( )
A.白磷没有毒性而红磷有剧毒 B.白磷在空气中加热到260 ℃可转化为红磷
C.白磷可用于制造安全火柴 D.少量的白磷应保存在水中
解析:此题考查红磷、白磷的性质比较与应用,难度不大,只需记住它们的性质即可。白磷必须隔绝空气加热才可转变为红磷,否则将会燃烧;白磷着火点低,在空气中因氧化放热而易自燃,且有剧毒,所以用于制安全火柴的是红磷;为防止白磷被氧化,可加水密封以隔绝空气。
答案:D
5.NO、NO2均可与NH3反应转化为无害的N2和H2O,现有3.0 L NO、NO2的混合气体,当耗用3.0 L NH3时,可全部转化为N2和H2O,则NO与NO2的体积之比为(体积均为同温、同压下测定)( )
A.1∶1 B.1∶2 C.1∶3 D.任意比
解析:存在4NO+5NH3====4N2+6H2O,6NO2+8NH3====7N2+12H2O反应,依据氧化还原反应的计算规则--化合价升高和降低的价态相等,知道NO与NO2的体积之比为1∶1,故A正确。
答案:A
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
解析:设每种气体的体积为1体积,则:(1)中剩余1+(1/3)=4/3体积气体;(2)中剩余3/4体积的氧气;(3)中剩余1体积的氮气。显然选择B。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com