
题目列表(包括答案和解析)
10.现有一同学想研究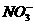 表现氧化性的条件,请你为他设计最简单的实验方案,药品、仪器自选。
表现氧化性的条件,请你为他设计最简单的实验方案,药品、仪器自选。
(1)使用材料:__________________________________________________________________。
(2)实验步骤:__________________________________________________________________。
(3)结论:______________________________________________________________________。
答案:(1)①所用试剂:Cu片,稀HNO3,NaNO3和稀HCl;
②所用仪器:试管、试管夹、酒精灯、镊子
(2)①取一试管放入Cu片,加入稀HNO3,用酒精灯适当加热,观察试管口气体的颜色;
②另取一试管放入Cu片,加入NaNO3,适当加热,观察现象,待试管冷却后在上述试管的溶液中再加入稀HCl,适当加热,观察现象
(3)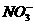 在酸性的环境中表现氧化性
在酸性的环境中表现氧化性
9.为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图8-5所示的实验装置。实验时,将分液漏斗的活塞打开,从U形管的长管口注入稀硝酸,一直到U形管的短管口单孔塞下沿且液面上不再留有气泡为止。关闭活塞,并用酒精灯在U形管短管下微热。当铜丝上有气泡产生时,立即撤去酒精灯。试完成下列问题:
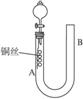
图8-5
(1)反应一段时间后,出现的现象是_____________________________________________。
(2)若将活塞缓缓打开,分液漏斗内的现象是_____________________________________。
(3)写出生成一氧化氮的离子方程式_____________________________________________。
解析:装置A处铜与硝酸发生反应:3Cu+2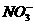 +8H+====3Cu2++2NO↑+4H2O,其现象是铜丝周围产生气泡,铜丝逐渐溶解,溶液变黑,澄清后变为蓝色,因有无色气体产生,压强增大,A处液面下降,B处液面上升。若将分液漏斗活塞打开,A处液面上升,将NO无色气体压入分液漏斗中,与空气接触,产生红棕色气体。
+8H+====3Cu2++2NO↑+4H2O,其现象是铜丝周围产生气泡,铜丝逐渐溶解,溶液变黑,澄清后变为蓝色,因有无色气体产生,压强增大,A处液面下降,B处液面上升。若将分液漏斗活塞打开,A处液面上升,将NO无色气体压入分液漏斗中,与空气接触,产生红棕色气体。
答案:(1)铜丝周围冒气泡,溶液逐渐变蓝,A处液面下降,B处液面上升
(2)产生红棕色气体
(3)3Cu+2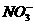 +8H+====3Cu2++2NO↑+4H2O
+8H+====3Cu2++2NO↑+4H2O
8.将红热固体单质甲,投入显黄色的溶液乙中,剧烈反应产生混合气体A,A在常温下不与空气反应,根据下列变化填空:
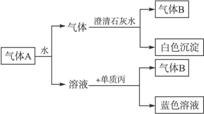
(1)甲是____________,乙是____________,丙是____________;
(2)混合气体A的主要成分是____________;
(3)气体B是________________,蓝色溶液是___________________。
解析:本题可从蓝色溶液(含Cu2+)和白色沉淀(为CaCO3)逆推,单质丙为Cu,与之反应的溶液为HNO3;上面的气体中含CO2,因该气体是气体A通过水后产生的,故气体B只能是NO,气体A则应为CO2和NO2的混合物,进一步推出红热固体单质甲为碳,显黄色的溶液乙为浓硝酸。
答案:(1)碳 浓HNO3 Cu (2)NO2和CO2 (3)NO Cu(NO3)2溶液
7.某金属的硝酸盐加热分解生成的NO2和O2的物质的量之比为8∶1。在加热过程中,该金属元素的化合价( )
A.降低 B.升高 C.不变 D.无法确定
解析: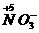 -
-
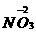 -
-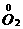
生成8 mol NO2得电子:
8 mol×(5-4)=8 mol
生成1 mol O2失电子:
1 mol×[0-(-2)]×2=4 mol
在氧化还原反应中,由于氧化剂得电子总数与还原剂失电子总数相等,因此金属元素一定失电子,化合价升高。
答案:B
6.对下列事实的解释正确的是( )
A.浓硝酸通常保存在棕色的试剂瓶中,说明浓硝酸不稳定
B.不用浓硝酸和铜屑反应制取硝酸铜,说明浓硝酸具有挥发性
C.铁与稀硝酸反应溶液呈浅绿色,说明稀硝酸不能氧化Fe2+
D.锌与稀硝酸反应得不到氢气,说明稀硝酸能使锌钝化
解析:用化学知识分析观察到的事实,找出合理的解释,要特别注意事实正确,物质的某性质也正确,但事实与该性质之间无联系,或该性质不是产生这一事实的主要原因的问题。HNO3属于不稳定的酸,见光、受热易分解,故应避光保存,用棕色瓶可达到避光的目的,A项正确。工业上不用浓硝酸和铜反应制硝酸铜,不是因为浓硝酸有挥发性,而是因为硝酸与铜反应会产生污染性气体NO2,同时又多消耗了硝酸,Cu+4HNO3====Cu(NO3)2+2NO2↑+2H2O,B项错误。铁与稀硝酸反应时,稀硝酸的氧化性仍可将铁氧化成Fe(NO3)3,溶液呈黄色,现反应后溶液呈浅绿色,那是因为过量的Fe与Fe(NO3)3反应生成了Fe(NO3)2,而不是因为稀硝酸不能氧化Fe2+,C项错误。硝酸与金属发生反应时,一般都是+5价的氮元素起氧化作用,故反应不能产生H2,而是产生低价的含氮物质,D项错误。
答案:A
1.5 mol 5 mol 1 mol V
由计算可知H+过量,Cu与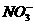 完全反应,得NO的体积为V=22.4 L,因此应选C项。
完全反应,得NO的体积为V=22.4 L,因此应选C项。
答案:C
5.在含有1 mol HNO3和2 mol H2SO4的混合稀溶液中,加入1.5 mol Cu,加热,充分反应后产生的气体体积在标准状况下约为( )
A.5.6 L B.11.2 L C.22.4 L D.44.8 L
解析:因Cu与稀硝酸反应:3Cu+8HNO3====3Cu(NO3)2+2NO↑+4H2O
由化学方程式可知Cu过量,这时H2SO4中的H+与Cu(NO3)2的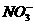 组合成HNO3再与Cu反应。因此该反应可用如下离子方程式表示:
组合成HNO3再与Cu反应。因此该反应可用如下离子方程式表示:
3Cu+ 8H+ + 2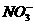
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
3 mol 8 mol 2 mol 44.8 L
4.(2010天津河西检测)已知单质铁溶于一定浓度的硝酸溶液中反应的离子方程式为:aFe+b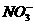 +cH+====dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数均为正整数)。若a=12,且铁和硝酸恰好完全反应,则b的取值范围是( )
+cH+====dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数均为正整数)。若a=12,且铁和硝酸恰好完全反应,则b的取值范围是( )
A.6<b<12 B.30<b<48 C.8<b<12 D.6<b<9
解析:若a=12,当金属铁全部转化为Fe2+时,失去电子的数目为24e-,当金属铁全部转化为Fe3+时,失去电子的数目为36e-,故金属铁失电子的数目范围为(24,36)。若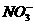
 NO,则有24<3b<36,即8<b<12;若
NO,则有24<3b<36,即8<b<12;若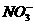
 N2O,则有24<4b<36,即6<b<9。要注意取并集,因此b的取值范围是6<b<12。
N2O,则有24<4b<36,即6<b<9。要注意取并集,因此b的取值范围是6<b<12。
答案:A
3.(2010山东潍坊质检)将足量的铜屑加入到浓度均为2 mol·L-1的HNO3和H2SO4的混合溶液100 mL中,充分反应后,转移电子的物质的量为( )
A.0.6 mol B.0.8 mol C.0.45 mol D.0.4 mol
解析:反应的离子方程式为:3Cu+8H++2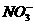 ====3Cu2++2NO↑+4H2O
====3Cu2++2NO↑+4H2O
HNO3与H2SO4的混合液中共有H+0.6
mol,共有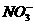 0.2 mol。
0.2 mol。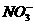 过量,参加反应的
过量,参加反应的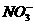 为0.15 mol,转移的电子为0.45 mol。
为0.15 mol,转移的电子为0.45 mol。
答案:C
2.现有下列物质:①氯水 ②氨水 ③浓硝酸④氢氧化钠 ⑤溴,其中必须保存在棕色瓶里的是( )
A.全部 B.①③和⑤ C.①和③ D.①②和④
解析:氯水见光发生反应2HClO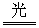 2HCl+O2↑而变质,浓硝酸见光分解:4HNO3
2HCl+O2↑而变质,浓硝酸见光分解:4HNO3 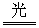 4NO2↑+O2↑+2H2O,为防止它们分解变质,必须储存在棕色瓶里。
4NO2↑+O2↑+2H2O,为防止它们分解变质,必须储存在棕色瓶里。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com