
题目列表(包括答案和解析)
18.在一个温度恒定的密闭容器中,SO2和O2发生反应。已知1 mol SO2和足量O2完全反应,放出的热量为Q。请按要求回答下列问题。
[恒压条件下]
(1)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成0.9 mol SO3,这时SO2的转化率为__________。
(2)若开始时放入4 mol SO2和2 mol O2,达平衡后,生成SO3的物质的量为__________,反应放出的热量为__________。
[恒容条件下]
(3)若开始时放入1 mol SO2和0.5 mol O2,达平衡后,生成a mol SO3,则a__________0.9(填“>”、“<”或“=”);
(4)若令x、y和z分别代表初始加入SO2、O2和SO3的物质的量,要使达平衡时,反应混合物中三种气体的物质的量分别与(3)中平衡时完全相同,则x、y、z必须满足的一般条件是__________。
(用两个代数式表示,其中一个只含x、y,另一个含x、z)
答案:(1)90% (2)3.6 mol 3.6Q
(3)< (4)x=2y,x+z=1
17.(2009·巢湖模拟)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。
为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3(OH)(g)+H2O(g);
CH3(OH)(g)+H2O(g);
ΔH=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
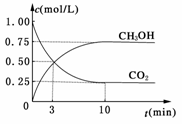
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________mol/(L·min)。
②该反应的平衡常数表达式为__________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)有人提出,可以设计反应2CO===2C+O2(ΔH>0、ΔS<0)来消除CO的污染。请你判断是否可行并说出理由:
________________________________________________________________________
解析:(1)①由图像可知反应10 min时达平衡状态,此时Δc(CO2)=1.00 mol/L-0.25 mol/L=0.75 mol/L,由反应方程式可知Δc(H2)=3Δc(CO2)=2.25 mol/L,则v(H2)===0.225 mol/(L·min)。③因该可逆反应正向为放热反应且为气体物质的量减小的反应,故升高温度,平衡向逆反应方向移动,使减小,A项错误;再充入1 mol CO2和3 mol H2,相当于增大压强,平衡向正反应方向移动,使增大,D正确;因容器体积不变,若充入He(g)使体系压强增大,不改变各物质的浓度,平衡不发生移动,不变,B错误,若将生成物H2O(g)从体系中分离,则平衡向正反应方向移动,增大,C正确。
(2)因为ΔH>0,ΔS<0,则ΔG=ΔH-TΔs>0,故该反应不能自发进行。
答案:(1)①0.225
② ③C、D
(2)不可行,该反应是一个焓增、熵减的反应,任何情况下都不能自发进行
16.(2009·宁厦、辽宁理综)在一定温度下,反应H2(g)+X2(g)
 HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于 ( )
HX(g)的平衡常数为10。若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于 ( )
A.5% B.17% C.25% D.33%
解析:本题考查平衡常数、分解率的计算。设分解率为x
H2(g)+X2(g)HX(g)
始态 0 0 1 mol·L-1
平衡态
k==10
解得x=约17%
答案:B
15.(2009·全国理综I)下图表示反应X(g)
 4Y(g)+Z(g);ΔH<0,在某温度时X的浓度随时间变化的曲线:
4Y(g)+Z(g);ΔH<0,在某温度时X的浓度随时间变化的曲线:
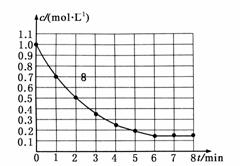
下列有关该反应的描述正确的是 ( )
A.第6 min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
解析:本题具体考查化学反应速率与化学平衡部分知识,关键是深刻理解“勒夏特列原理”并结合具体反应灵活应用。A项,考查化学平衡的特点,由图知:6 min以后,反应物X浓度不再改变,说明达到了平衡。但化学平衡是动态平衡,反应未终止。B项,X的转化率计算:×100%=85%。C项,该反应ΔH<0,据“勒夏特列原理”,升温,平衡向着使体系降温的方向移动,即平衡逆移,故X的转化率降低。D项,考查温度与速率的关系。降低温度,v正、v逆都减小,但不会是同样倍数,与该反应热效应有关。正反应放热,降低温度,平衡正向移动,说明v正′>v逆′。
答案:B
14.(2009·江苏化学)I2在KI溶液中存在下列平衡:
I2(aq)+I-(aq)
 I(aq)某I2、KI混合溶液中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
I(aq)某I2、KI混合溶液中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 ( )
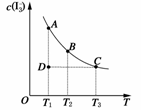
A.反应I2 (aq)+I-(aq)===I(aq)的ΔH>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,一定有v正>v逆
D.状态A与状态B相比,状态A的c(I2)大
解析:本题为化学平衡的图象题,考查化学平衡移动原理及识图能力。由图象可知,反应I2(aq)+I-(aq)
 I(aq)随着T的增加I的浓度减小,反应向逆方向进行,所以反应的ΔH<0,A不正确;温度由T1→T2,温度升高,平衡左移,平衡常数减小,即K1>K2,B正确:D点不是平衡状态,平衡向右移动,即v正>v逆,C正确;状态A时,c(I)大,则c(I2)小,D不正确。
I(aq)随着T的增加I的浓度减小,反应向逆方向进行,所以反应的ΔH<0,A不正确;温度由T1→T2,温度升高,平衡左移,平衡常数减小,即K1>K2,B正确:D点不是平衡状态,平衡向右移动,即v正>v逆,C正确;状态A时,c(I)大,则c(I2)小,D不正确。
答案:BC
13.(2009·广东化学)取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)
 N2O4(g) ΔH<0
N2O4(g) ΔH<0
反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是 ( )
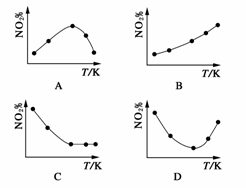
解析:在恒容状态下,在5个相同的容器中同时通入等量的NO2,反应相同时间。那么则有两种可能,一是已达到平衡状态,二是还没有达到平衡状态,仍然在向正反应方向移动。若5个容器在反应相同时间下,均已达到平衡,因为该反应是放热反应,温度越高,平衡向逆反应方向移动的程度越大,NO2的百分含量随温度升高而升高,所以B正确。若5个容器中有未达到平衡状态的,刚反应时,平衡向右移动,NO2的含量减少,而后达到平衡时,由于该反应为放热反应,升高温度,平衡向左移动,NO2的含量逐渐增加,故D项可能与实验结果相符合。
答案:BD
12.(2009·济南市高三模拟)向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g)+O2(g)催化剂加热2SO3(g);ΔH=-197.74 kJ·mol-1,4 min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2与O2的转化率相等。下列说法中,不正确的是 ( )
A.达到平衡时再充入2 mol SO2反应的ΔH保持不变
B.用O2表示4min内的反应速率为0.1 mol·(L·min)-1
C.再向容器中充入1 mol SO3,达到新平衡,v(SO2):v(O2)=2?1
D.4 min后,若升高温度,平衡向逆反应方向移动,平衡常数K增大
解析:ΔH是焓变(反应热),是一个定值,选项A正确;该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,选项D错误。
答案:D
11.(2009·山东省济宁市第一学期高三质检)在密闭容器中,反应X2(g)+Y2(g)
 2XY(g);ΔH<0,达到甲平衡时,再改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g);ΔH<0,达到甲平衡时,再改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
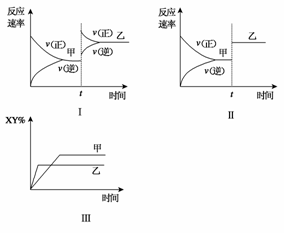
A.图Ⅰ是加入适当催化剂的变化情况
B.图Ⅱ是扩大容器体积的变化情况
C.图Ⅲ是增大压强的变化情况
D.图Ⅲ是升高温度的变化情况
答案:D
10.(2009·巢湖模拟)对于可逆反应:mA(g)+nB(g)
 xC(g);ΔH=?,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是 ( )
xC(g);ΔH=?,在不同温度及压强(p1,p2)条件下,反应物A的转化率如图所示,下列判断正确的是 ( )
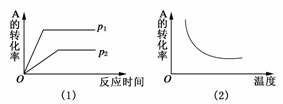
A.ΔH>0,m+n>x B.ΔH<0,m+n>x
C.ΔH<0,m+n<x D.ΔH<0,m+n>x
解析:由图(1)可知可逆反应在p1压强先达平衡,故p1>p2 ,且在p1时A的转化率较p2时高,说明增大压强,平衡向正反应方向移动,故m+n>x;由图(2)知升高温度时A的转化率减小,即平衡向逆反应方向移动,故该可逆反应正向为放热反应,ΔH<0,D项正确。
答案:D
9.(2009·潍坊模拟)现有下列两个图象:
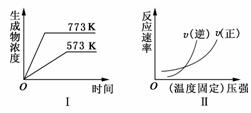
下列反应中符合上述图像的是 ( )
A.N2(g)+3H2(g)
 2NH3(g);ΔH<0
2NH3(g);ΔH<0
B.2SO3(g)
 2SO2(g)+O2(g);ΔH>0
2SO2(g)+O2(g);ΔH>0
C.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g);ΔH<0
4NO(g)+6H2O(g);ΔH<0
D.H2(g)+CO(g)
 C(s)+H2O(g);ΔH>0
C(s)+H2O(g);ΔH>0
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com