
题目列表(包括答案和解析)
29. 一氯乙酸(ClCH2COOH)是无色晶体,可溶于水,其水溶液显酸性,是重要的有机反应中间体,可进行多种反应。
(1)一定条件下,一氯乙酸与苯可直接合成苯乙酸,其反应方程式是______________________ (不要求标出反应条件)。
(2)工业上将一氯乙酸、2–丙醇与浓硫酸混合加热制备一氯乙酸异丙酯,一氯乙酸异丙酯的结构简式为_______ __________________ ;反应过程中,可能产生的有机副产物有异丙醚[(CH3)2CHOCH(CH3)2]和________ ________________(填结构简式)。
(3)pKa常用于表示物质的酸性强弱,pKa的数值越小,该物质的酸性越强。已知卤素原子对饱和脂肪酸的酸性影响具有相似性。25℃时一些卤代饱和脂肪酸的pKa数值如下:
|
卤代酸 |
F3CCOOH |
Cl3CCOOH |
F2CHCOOH |
FCH2COOH |
 CH3CH2CHCOOH CH3CH2CHCOOH |
|
pKa |
0.23 |
0.65 |
1.24 |
2.66 |
2.85 |
|
卤代酸 |
ClCH2COOH |
BrCH2COOH |
ICH2COOH |
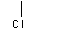 CH3CHCH2COOH CH3CHCH2COOH |
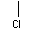 CH2CH2CH2COOH CH2CH2CH2COOH |
|
pKa |
2.86 |
2.90 |
3.18 |
4.06 |
4.52 |
可见,25℃时卤素原子对卤代饱和脂肪酸的酸性影响有(写出2条即可):
①____________________________________________________________________;
②____________________________________________________________________;
根据上述数据和规律判断, Cl2CHCOOH的pKa的数值范围为_________________。
化学知识点考察检测(4)
12.铜的冶炼大致可分为:(1)富集:将硫化物矿进行浮选; (2)焙烧:主要反应为:2CuFeS2 +4O2 = Cu2S+3SO2 +2FeO(炉渣); (3)制粗铜:在1200℃发生的主要反应为:2Cu2S +3O2 = 2Cu2O +2SO2;2Cu2O + Cu2S =6Cu +SO2↑; (4)电解精炼。 下列说法正确的是
A.上述灼烧过程的尾气均可直接排入到空气中
B.由6mol CuFeS2 生成6molCu,上述共消耗15molO2
C.在反应2Cu2O + Cu2S =6Cu +SO2↑中,作氧化剂的只有Cu2O
D.电解精炼时,粗铜应与外电源负极相连
*13. 下列比较中,可能正确的是
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大
B.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:
c(NH4+) > c (Cl―) > c (Na+) > c (OH-) >c (H+)
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:
c (Na+) +c(H+) = c (S2―) +c (HS―)+c (OH―)
D.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;
c(NH4+) 由大到小的顺序是:①>②>③>④
第Ⅱ卷
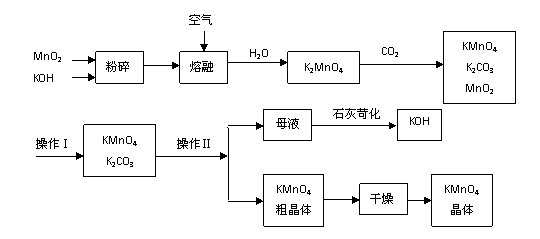
*26.工业制备的高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是___ ___(填代号)。
a. 84消毒液(NaClO溶液) b. 双氧水 c. 苯酚 d. 75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是____ ___(填代号)。
a. 浓硝酸 b. 硝酸银 c. 氯水 d. 烧碱
(3)上述流程中可以循环使用的物质有 、 (写化学式)。
(4)若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
(5)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
a. 石灰石 b. 稀HCl c. 稀H2SO4 d. 纯碱
(6)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在_____ _____(填性质)上差异,采用____________(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
 *27. 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2=2MgO+C)
*27. 已知SiO2、SO2、CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定的相似性(提示:2Mg+CO2=2MgO+C)
Ⅰ、用如图所示的装置进行Mg和SO2的实验:
⑴选择制取SO2的合适试剂 。
①10%的H2SO4溶液;②80%的H2SO4溶液;③Na2SO3固体; ④CaSO3固体
⑵写出装置B中发生的主要反应的化学方程式:
⑶你认为该装置是否有不足之处? ,如果有,请一一说明
Ⅱ、某研究性学习小组进行了“实验室制Si”的研究,它们以课本为基础,查阅资料后得到以下可供参考的信息:
①工业上在高温时用C还原SiO2可制得Si; ②Mg在点燃的条件下即可与SiO2反应;
③金属硅化物与稀H2SO4反应生成硫酸盐和SiH4;
④Si和SiO2均不与稀H2SO4反应; ⑤SiH4在空气中自燃。
他们在研究报告中记载着“……选用合适的物质在适宜的条件下充分反应;再用足量稀H2SO4溶解固体产物;然后过滤、洗涤、干燥;最后称量……在用稀H2SO4溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的63%左右”。
⑷该小组“实验室制Si”的化学方程式是
⑸你估计“用稀H2SO4溶解固体产物时,发现有爆鸣声和火花”的原因是
*28. 将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。

|
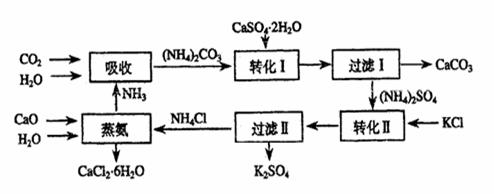
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要 等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3)过滤I操作所得固体中,除CaCO3外还含有 (填化学式)等物质,
该固体可用作生产水泥的原料。
(4)过滤I操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32-的方法是:
。
(5)硫酸钙结晶水合物(CaSO4·6H2O)是目前常用的无机储热材料,选择的依据是 。
a.熔点较低(29℃熔化) b.能导电 c.能制冷 d.无毒
(6)上述工艺流程中体现绿色化学理念的是 。
11.下列说法中,不正确的是
A. 用惰性电极电解CuSO4溶液(足量)过程中,溶液的颜色逐渐变浅,pH逐渐增大
B. 在正常情况下,人体血液的pH应保持弱碱性范围,为了维持人体细胞内的酸碱平衡,人需要选择不同的酸性食物或碱性食物来加以控制。
C. 在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+可能大量存在
D. 室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
10.以下物质的制备原理错误的是( )
A. 无水氯化镁的制备 :MgCl2·6H2O MgCl2+ 6H2O
MgCl2+ 6H2O
B. 铝的制备:2Al 2O3(熔融)  4Al+3O2↑
4Al+3O2↑
C. 烧碱的制备:2NaCl+2H2O 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D. 漂白粉的制备: 2Ca(OH)2+ 2Cl2 = Ca(ClO)2 +CaCl2+2H2O
7.下列中学常见实验的现象或表述正确的是:
A.做温度对化学平衡影响的实验,将装有NO2与N2O4混合气体的两个玻璃球一个浸入热水,另一个浸入冷水,浸入热水的玻璃球里气体的颜色较浅
B.检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.向饱和FeCl3溶液中滴入少量NaOH溶液,煮沸后即得红棕色Fe(OH)3胶体。
*8.实验室制备下列物质的方法合理可行的是
A、苯与浓溴水在铁粉作用下,以制取溴苯
B、食醋和无水酒精及浓硫酸共热,以制取乙酸乙酯
C、干馏煤可以得到甲烷、苯和氨等重要化工原料
D、无水乙醇与5 mol/L的硫酸共热至170℃,以制取乙烯
*9.青石棉(cricidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,
其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法
不正确的是
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1mol青石棉能使1molHNO3被还原
6.从宏观方面来说物质由元素组成,从微观方面来说物质由粒子构成。下列说法中不正确的是
A.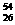 Fe与
Fe与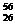 Fe互为同位素
Fe互为同位素
B.只由一种分子组成的物质一定为纯净物
C.质子数和电子数相等的某微粒,可能是一种分子
D.1mol Na2O2固体中阴、阳离子个数比为1:1
29.(1)C9H10O3 (2)①②③
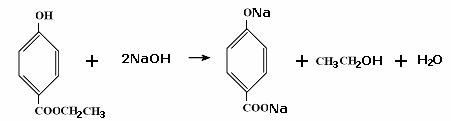 (3)
(3)
(4) ②④ ①②④
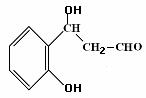
(5)略
27. (1)Cu(NO3)2 (2)1 4 (3)3Fe2++NO3-+4H+=3Fe3++NO+2H2O
(4)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2
26. 、
、
⑴ (1分) 第三周期第ⅥA族(1分)
⑵ 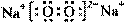 (1分) H-O-O-H (1分)极性键和非极性键(1分)
(1分) H-O-O-H (1分)极性键和非极性键(1分)
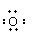
 ⑶ Na• + + •Na → Na+ [ ] 2-Na+ (2分)
⑶ Na• + + •Na → Na+ [ ] 2-Na+ (2分)
⑷ Na2O2 + H2SO4 = H2O2 + Na2SO4 (2分) ⑸ OH- + H+ = H2O (2分)
⑹ H+ + HSO3- = SO2 ↑+ H2O(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com