
题目列表(包括答案和解析)
4.碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,下列说法错误的是 ( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+2H2O+2e-=2MnOOH+2OH-
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol 电子,锌的质量理论上减少6.5 g
答案:C
3.(2009·潮阳模拟)利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,如废铝罐和碳棒,食盐水等材料制作可用于驱动玩具的电池。上述电池工作时,有关说法正确的是 ( )
A.铝罐将逐渐被腐蚀
B.碳棒上发生的反应为:O2+4e-===2O2-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒的质量会减轻
答案:A
2.(2009·巢湖模拟)将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是 ( )

A.镁比铝活泼,镁失去电子被氧化成Mg2+
B.铝是电池的负极,开始工作时溶液中会立即有白色沉淀生成
C.该装置的内、外电路中,均是电子的定向移动形成电流
D.该装置开始工作时,铝片表面的氧化膜可不必处理
解析:对NaOH溶液而言Al比Mg活泼,故Al为负极,Mg为正极,负极电极反应式为:Al+4OH--3e-===AlO+2H2O,故A、B两项均不正确;内电路是阴、阳离子定向移动形成电流,故C项不正确;Al表面氧化膜不必另外处理,溶液中NaOH即可使其溶解,故D项正确。
答案:D
1.下列说法正确的是 ( )
A.构成原电池正极和负极的材料必须是金属
B.在原电池中,电子流出的一极是负极,该电极被还原
C.实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应
D.原电池可以把物质内部的能量全部转化为电能
答案:C
18.(2009·海淀)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体__________g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):__________。
|
名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
|
仪器 |
 |
 |
 |
|
序号 |
a |
b |
c |
|
名称 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
 |
 |
 |
|
序号 |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
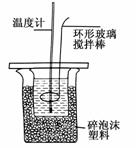
(1)写出该反应的热化学方程式(中和热为57.3kJ·mol):________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验 次数 |
起始温度T1/℃ |
终止温度T2/℃ |
温度差平均值(T2-T1)℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容C=4.18J/(g·℃)。则中和热ΔH=__________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
答案:Ⅰ.(1)5.0 (2)a、b、e
Ⅱ.(1)H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(e);ΔH=-57.3kJ·mol-1
(2)①4.0 ②-53.5 kJ·mol-1 ③a、c、d
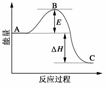
17.(2009·宁夏、辽宁)2SO2(g)+O2(g)催化剂Δ2SO3(g)反应过程的能量变化如下图所示。已知1 mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示__________、__________,E的大小对该反应的反应热有无影响?__________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?__________________,理由是__________________;
(2)图中ΔH=__________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式__________;
(4)如果反应速度v(SO2)为0.05 mol·L-1·min-1,则v(O2)=__________mol·L-1·min-1、v(SO3)=__________mol·L-1·min-1;
(5)已知单质硫的燃烧热为296kJ·mol-1,计算由S(s)生成3 mol SO3(g)的ΔH(要求计算过程)。
解析:(1)反应热只与反应的始态和终态有关,催化剂能降低活化能使E值减小;(2)图示为2 mol SO2反应的情况;(3)四价钒化合物为VO2;(4)依计量数之比可推出;(5)依盖期定律推出。
答案:(1)反应物能理 生成物能量 没有影响 降低 催化剂能降低活化能使E值减小
(2)-198
(3)SO2+V2O5===SO3+2VO2、4VO2+O2===2V2O5
(4)0.025 0.05
(5)S(s)+O2(g)===SO2(g);ΔH1=-296kJ·mol-1、
SO2(g)+O2(g)===SO3(g);ΔH=-99kJ·mol-1、
3S(s)+O2(g)===3SO3(g);ΔH=(ΔH1+ΔH2)×3=-1185kJ·mol-1
16.(2009·惠州模拟)0.3 mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5kJ热量。下列判断正确的是 ( )
A.该反应是非氧化还原反应
B.在理论上可以利用该反应的原理做成燃料电池
C.该反应的热化学方程式为:B2H6(g)+3O2(g)===B2O3(s)+3H2O(l);ΔH=+2165kJ/mol
D.每生成18 g水,该反应转移2 mol电子
答案:B
15. (2009·临沂模拟)如图,a曲线是198K、101kPa时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是 ( )
(2009·临沂模拟)如图,a曲线是198K、101kPa时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是 ( )
A.该反应的热化学方程式为:N2+3H22NH3;ΔH=-92kJ·mol-1
B.b曲线是升高温度时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.在198K、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ则184>Q2>2Q1
答案:D
14.(2009·华南师大附中模拟)下列各组变化中,化学反应的热量变化前者小于后者的一组是 ( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH1;
CH4(g)+2O2(g)===CO2(g)+2H2O(g);ΔH2
②2H2(g)+O2(g)===2H2O(l);ΔH1
H2(g)+O2(g)===H2O(l);ΔH2
③t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡 状态时放出的热量分别为O1、O2
④CaCO3(s)===CaO(s)+CO2(g);ΔH1
CaO(s)+H2O(l)===Ca(OH)2(s);ΔH2
A.①②③ B.②④ C.②③④ D.③④
答案:A
13.(2009·全国卷Ⅱ)已知:2H2(g)+O2(g)===2H2O(l);ΔH=-571.6kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890kJ·mol-1现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是 ( )
A.1?1 B.1?3 C.1?4 D.2?3
解析:n(混)==5 mol,设H2、CH4的物质的量分别为x、y,则有
解出x=1.25 mol,y=3.75 mol,=。
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com