
题目列表(包括答案和解析)
3.在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法中不正确的是
A.该反应的化学方程式为4NH3+3F2=NF3+NH4F
B.M是极性分子,其还原性比NH3弱
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
2.下列说法正确的是(设NA为阿伏加德罗常数)
A.通常状况时,28g氮气所含原子数目为NA
B.常温常压下,1mol二氧化氮完全被碱吸收,消耗NA个氢氧根离子
C.常温常压下,11.2L氯气所含有的原子数目为NA
D.标准状况下,22.4L一氯甲烷和二氯甲烷的混合物所含分子数为NA
1.对下列事实的解释正确的是
A.浓硝酸在光照下变黄,说明浓硝酸不稳定,且产物有红棕色气体且可溶于浓硝酸
B.向某溶液中加入氯化钡溶液和稀硝酸,有白色沉淀生成,说明该溶液中一定有SO42-
C.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷、浓硫酸中钝化
D.氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气与淀粉反应
11.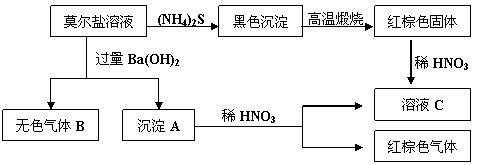 莫尔盐是硫酸盐的一种复盐,它是一种重要的化学试剂,有如下反应:
莫尔盐是硫酸盐的一种复盐,它是一种重要的化学试剂,有如下反应:
根据以上关系,按要求填空:
(1)气体B的分子式为___________,其电子式为_______________。
(2)莫尔盐的化学式为______________,与(NH4)2S反应的离子方程式为______
_________________________________________。
(3)沉淀A与稀HNO3反应的离子方程式为___________________________。
(4)与2.7gAl完全反应的稀HNO3最多溶解Fe的质量为( )
A 2.8g B 5.6g C 2.7g D 8.4g
(5)Cu2S与一定浓度的稀HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1:1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A 1:7 B 1:9 C 1:5 D 2:9
[解析]:本题主要考查无机物间的相互转化、离子方程式的书写、电子式,并以无机推断为载体,进行相关的计算,并考查到氧化还原反应中的电子得失守恒规律在计算中的应用。
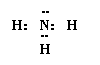
(1)NH3;(1分)(2分)
(2)(NH4)2Fe(SO4)2;(2分) Fe2+ + S2+ ===FeS↓ (2分)
(3)3Fe(OH)2 + 10H+ + NO3- === 3Fe3+ + 8H2O + NO↑ (2分)
(4)D (3分)
(5)A (3分)
10.化合物A(C4H10O)是一种有机溶剂,A可以发生以下变化:

(1)1A分子中的官能团名称是__________________。
2A只有一种一氯代物B。写出由A转化为B的化学方程式__________________。
3A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种。F的结构简式是_____________________。
(2)化合物“HQ”(C6H6O2)可用作显影剂,“HQ”可以与氯化铁溶液发生显色反应。“HQ”还能发生的反应是(选填序号)___________。
1加成反应 2氧化反应 3加聚反应 4水解反应
“HQ”的一硝基取代物只有一种。“HQ”的结构简式是_________________。
(3)A与“HQ”在一定条件下相互作用形成水与一种食品抗氧化剂“TBHQ”,“TBHQ”与氢氧化钠溶液作用得到化学式为C10H12O2Na2的化合物。“TBHQ”的结构简式为___________________。
[解析]:本题主要考查有机化合物的相互转化、同分异构体、官能团的性质、有机反应类型、结构式的推断及结构简式的书写。
(1)1羟基(2分)
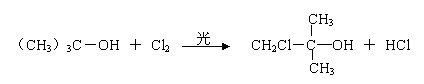
2(3分)
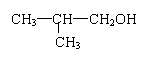
3(3分)

(2)12(2分);(3分)

(3)(3分)
9.(1)一定条件下的可逆反应:mA(g) + nB(g)  pC(g)
+ qD(g)的化学平衡常数K可表示为:
pC(g)
+ qD(g)的化学平衡常数K可表示为: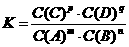 ,则K值越大,表示可逆反应的进行程度______________,K值大小与温度的关系是:温度越高,K值_________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
,则K值越大,表示可逆反应的进行程度______________,K值大小与温度的关系是:温度越高,K值_________(填“一定增大”、“一定减小”或“可能增大也可能减小”)。
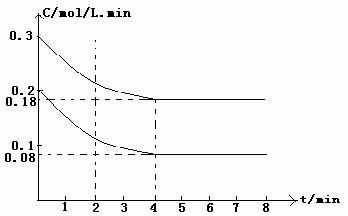
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+ H2O(g)
 CO2(g)
+ H2(g); △H<0, CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=_____________mol/L·min.
CO2(g)
+ H2(g); △H<0, CO和H2O浓度变化如下图,则0-4 min的平均反应速率v(CO)=_____________mol/L·min.
(3)T℃(高于850℃)时,在相同容器中发生上述反应,容器中各物质的浓度如右表:
|
t/min |
C(CO) |
C(H2O) |
C(CO2) |
C(H2) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
C1 |
C2 |
C3 |
C3 |
|
4 |
C1 |
C2 |
C3 |
C3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
1表中3-4 min之间反应处于___________状态;C1数值______0.08mol/L(填大于、小于或等于)。
 2反应在4-5min之间,平衡向逆方向移动,可能的原因是______________,表中5-6min之间数值发生变化,可能的原因是_________。(均为单选)
2反应在4-5min之间,平衡向逆方向移动,可能的原因是______________,表中5-6min之间数值发生变化,可能的原因是_________。(均为单选)
A 增加水蒸气
B 降低温度
C 使用催化剂 D增加氢气浓度
[解析]:本题主要考查一定条件下的可逆反应,在外界条件发生变化时,化学平衡的移动、化学反应速率的计算等知识。
(1)越大;可能增大也可能减小。(每空2分)
(2)0.03(2分)
(3)1平衡;>. 2D; A.(每空2分)
8.氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等,为获得纯净的氧化铜以探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜:
|


1步骤I的目的是除去不溶性杂质,操作是_______________________________。
2步骤II的目的是除铁,操作是滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液 pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液 pH=3.5的原因是______________________
__________________________________。
3步骤III的目的是得到CuSO4·5H2O晶体,操作是________________________,过滤,水浴加热烘干,水浴加热的特点是__________________________________。
(2)探究氧化铜的性质:
1取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积、质量分数为30%的H2O2溶液,只观察到A中的大量的气泡。结论是________
_____________________________________________________。
2为探究试管A中的反应速率,收集气体并测定其体积,必须的实验仪器有
______________________________________________________。
[解析]:本题主要考查物质的制法、化学实验的基本操作、仪器的使用、性质的运用等。
(1)1加适量的水溶解,搅拌、过滤。(3分)2使Fe3+全部转化为Fe(OH)3沉淀,而Cu2+不会转化为Cu(OH)2沉淀。(2分)3将CuSO4溶液加热至开始出现晶体时,停止加热;(2分)恒温且受热均匀,温度易于控制在100℃以下。(2分)
(2)1CuO可加快H2O2的分解的反应速率,是H2O2分解反应的催化剂。(3分)
2秒表、橡皮塞、导管、集气瓶、量筒。(3分)
7.用NA代表阿伏加德罗常数,下列说法正确的是( )
A 0.5 mol Al与跑题的盐酸反应转移电子数为NA。
B 标准状况下,11.2L SO3所含的分子数为0.5NA.
C 0.1 mol CH4 所含的电子数为NA。
D 46 g NO2和N2O4的混合气体中含有的分子数为NA。
[解析]:A项中Al-3e -=Al3+,则失去电子的物质的量为n(e-)=0.5 mol x 3=1.5mol。
B项中标准状况下,SO3为固体,故11.2L SO3的物质的量不一定是0.5 mol,含有的分子数也不能确定。
D项中用极值法求得46 g气体的物质的量为:46g÷46g/mol=1 mol, 46g÷92g/mol=0.5 mol,故含有的分子数为NA-0.5NA之间。本题正确选项为C。
6.为消去NO、NO2对大气的污染,常用碱液吸收其混合气体。a mol NO2和b mol NO组成的混合气体,用NaOH溶液吸收后无气体剩余。现有c mol/L NaOH 溶液,则需此NaOH溶液的体积是( )
A a/c L B 2a/c L C 2(a+b)/3c L D (a+b)/c L
[解析]:混合气体被NaOH溶液吸收后,NO和NO2气体都生成了NaNO2,据原子守恒,a mol NO2和b mol NO的混合气体被NaOH溶液吸收后,,消耗(a+b)mol NaOH溶液,故正确选项为D。
5.在一种酸性溶液中存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该项溶液中加入溴水,溴单质被还原,由此可推知该溶液中( )
A 一定含有I-,不能确定是否含有Cl-。 B 一定含有NO3-
C 不含有Fe3+,可能含有NO3-。 D 一定含有I-、NO3-和Cl-。
[解析]:加入溴水,溴单质被还原,说明该溶液中含有还原性离子,故该溶液中含有I-,肯定不含有Fe3+、NO3-,可能含有Cl-,故正确选项为A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com