
题目列表(包括答案和解析)
5. 下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量,数值为57.3 kJ
B.1 mol酸与1 mol碱完全反应放出的热量是中和热
C.在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D.表示中和热的离子方程式为
H+(aq)+OH-(aq)=H2O(l),ΔH=-57.3 kJ·mol-1
4. 下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
3. (2007年高考重庆卷·理综)已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收热量为( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
2. 下列变化过程中需要吸收能量的是( )
A.2H2+O2 2H2O
2H2O
B.CaO+H2O=Ca(OH)2
C.Cl+Cl  Cl2
Cl2
D.H2  H+H
H+H
1. 下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化
B.伴有能量变化的物质变化都是化学变化
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能不同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
16.(2009年福建高考)某研究性小组借助A-D的仪器装置完成有关实验
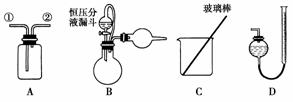
实验一:收集NO气体。
(1)用装置A收集NO气体,正确的操作是________(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
实验二:为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH===Na2ZnO3+H2↑,据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为V L(标准状况),w(Zn)=________。
(4)计算镀层厚度,还需要检索的一个物理量是________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2 g。
(6)w(Zn)=________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙________方案乙(填“优于”、“劣于”或“等同于”)。
[解析] (1)NO遇空气立即被氧化,故不能用排空气法收集,只能用排水法收集。排水时应用短进长出。
(2)方案甲:Zn和Fe中只有Zn可以与NaOH产生气体,通过排水收集气体,依据反应方程式即可算出Zn的质量分数。所以需要的装置有测H2的体积的D装置。
(3)Zn与H2之间量为1∶1,则n(Zn)=V/22.4 mol,w(Zn)=m(Zn)/m1=。
(4)有了Zn的质量,如果有密度,则可以求出Zn的体积,再由Zn的截面积,即可求出Zn的高度(厚度)。
(5)恒压式分液漏斗产生的气体有部分残留在分液漏斗上方,故排气时收集少了,所以用普通漏斗时收集的H2多一些,则计算出的Zn的量偏大。
(6)减少的质量即为Zn的质量。
(7)丙方案根据H2的质量差值,显然误差大,因为产生的H2质量很小,计算偏差大。
[答案] (1)c (2)D
(3)(或等其他合理答案)
(4)金属锌的密度(或其他合理答案)
(5)偏大 (6)(或其他合理答案)
(7)劣于
15.在浓硝酸中放入铜片:
(1)开始反应的化学方程式为__________________________________________________ ___________________________________________________________,
实验现象为_________________________________________。
(2)若铜有剩余,则反应将要结束时的化学方程式是_______________________________ _________________________________________________________________________________________________________________。
(3)待反应停止后,再加入少量质量分数为25%的稀硫酸,这时铜片上又有气泡产生,其原因是_______________________________________________________________________ ____________________________________。
(4)在标准状况下,若将12.8 g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6 L(不考虑2NO2N2O4)。则所消耗的硝酸的物质的量是________,所得气体的平均相对分子质量为________________________________________________________________________。
[解析] (2)随着反应的进行,硝酸浓度不断减小,故反应后阶段发生的是铜与稀HNO3的反应。
(4)n(NOx)==0.25 mol,故消耗n(HNO3)=2n(Cu)+n(NOx)=2×+0.25 mol=0.65 mol。
设产生NO2的物质的量为x,则NO的物质的量为(0.25 mol-x)。根据得失电子守恒,得下列方程
x·1+(0.25 mol-x)×3=×2
解得:x=0.175 mol。
所以所得气体的摩尔质量为:
=41.2 g·mol-1,
故所得气体的平均相对分子质量为41.2。
[答案] (1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 溶液逐渐变蓝,有红棕色气体逸出
(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(3)加入稀H2SO4后,与原溶液中的NO构成强氧化性的条件,又能与过量的Cu反应,反应原理(2)
(4)0.65 mol 41.2
14.铜与浓硝酸反应和铜与稀硝酸反应的产物不同,实验现象也不同。
(1)某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤。

药品:稀硝酸、稀盐酸、Zn粒、CaCO3固体
步骤:
①检查装置的气密性;
②________________________________________________________________________;
③________________________________________________________________________
______________________________;
④________________________________________________________________________;
⑤______________________________;
⑥用注射器向试管内推入氧气(或空气)。
(2)推入氧气或空气的目的是_______________________________________________。
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是______________________________________ __________________________________________________________________________________________________________;
另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之________________________________________________________________________________________________________________________________________________(简述实验方案和实验现象)。
[解析] 本题主要考查硝酸的性质(强氧化性)、化学实验等知识的应用及在实验中探索发现问题、解决问题的能力。
[答案] (1)②向试管中加入一定量的CaCO3固体
③向试管中倒入过量的稀HNO3,并迅速盖上带铜丝和导管的橡皮塞
④待反应完全后,将右边导管插入试管内接近液面
⑤将铜丝插入到溶液中
(2)检验生成的NO气体
(3)不同意 铜片质量相同,溶液体积相同,生成的Cu2+浓度相同 加热绿色溶液,有红棕色气体产生,溶液变成蓝色
13.(2010年淄博质检)某化学课外小组欲用固体与液体反应(不需加热),快速简便地制取一满瓶(125 mL)干燥的氧气。
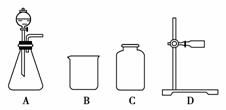
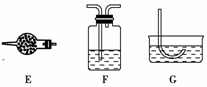
(1)从所提供的仪器(或装置)A至G中,选出所需要的(填序号)________。
(2)选用的试剂为______________________,化学反应方程式为_____________________ ______________________________________________________________________________。
(3)用上述所选的气体发生装置,除可制取O2、H2、CO2外,请于下表中写出还可用此装置制取的2种其他气体及制取该气体所需的试剂。
|
|
气体 |
所需试剂 |
|
① |
|
|
|
② |
|
|
[解析] 可利用Na2O2和H2O反应制取O2,可用碱石灰或浓H2SO4干燥O2。
[答案] (1)AE(或F)C
(2)Na2O2、H2O、碱石灰(或浓H2SO4) 2Na2O2+2H2O===4NaOH+O2↑(其他答案,合理即可)
(3)
|
|
气体 |
所需试剂 |
|
① |
NH3 |
浓氨水、生石灰 |
|
② |
SO2 |
Na2SO3、浓硫酸 |
12.已知A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,其中只有B为单质。若在常温下将气体D通入水中可以发生反应,生成C和E。工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答下列问题:
(1)B分子的电子式为________。
(2)实验室制取A的化学反应方程式为:_________________________________________ _______________________________________________________________。
(3)E具有不稳定性,因此实验室中保存E的方法是______________________________ __________________________________________________________________________________________________________________。
(4)工业上若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出此反应的化学方程式:_______________________________________________________ ___________________________________________________。当反应中转移的电子为3 mol时,被氧化的A在标准状况下的体积为________L。
[解析] (1)由题意可知:A中Y的价态最低,且可作生产硝酸的原料,故A为NH3;作为单质的B为N2。
(2)实验室制取NH3,通常以NH4Cl(s)和熟石灰混合共热制得。
(3)浓HNO3见光受热易分解,因此在保存时注意避光、阴凉。
(4)Cl2与NH3易发生反应:
 8NH3+3Cl2===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2
mol NH3被氧化
8NH3+3Cl2===6NH4Cl+N2,大量白烟是生成NH4Cl的缘故。每2
mol NH3被氧化
6e-
转移6 mol电子,故每转移3 mol电子被氧化的NH3在标准状况下的体积为:
1 mol×22.4 L·mol-1=22.4 L。
[答案] (1)··N⋮⋮N··
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
(3)密封于棕色试剂瓶,并置于阴凉处
(4)8NH3+3Cl2===6NH4Cl+N2 22.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com