
题目列表(包括答案和解析)
16.(8分)A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。
已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
(1)C与K的混合物工业上称为____________________________

(2)写出电解E水溶液的化学方程式__________________________________________。
(3)J与H反应的离子方程式为 。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
15.Ⅰ、(3分)下列有关实验说法错误的是___________
A.进行中和热测定时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
B.用10mL量筒量取5.80mL盐酸
C.乙醇中含有少量水可加入生石灰再蒸馏制得无水乙醇
D.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体
E.取用金属Na或K时,用剩的药品要放回原瓶
F.苯酚沾在皮肤上应立即用浓NaOH冲洗
G.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
Ⅱ。已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1-2 滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
⑴仅限选用的仪器和试剂有:烧杯、试管、玻璃棒、量筒、滴管、药匙;酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳 、硫氰化钾溶液 、硝酸银溶液 、淀粉碘化钾溶液,完成以下实验探究过程:
[提出假设]
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
[设计实验方案]
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案: 假设1方案: 。
假设2方案: 。
⑵根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉碘化钾溶液验证你的假设是否可行?_ (填“行”或“否”),理由是:_______________________________ 。
⑶若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为: 。
14.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是 ( )
A.最终得到7.8g的沉淀 B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
第Ⅱ卷(非选择题 共72分)
13.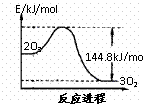 O3是重要的氧化剂和水处理剂,在平流层存在:2O3
O3是重要的氧化剂和水处理剂,在平流层存在:2O3 3O2,2O3
3O2,2O3 O+O2。粒子X能加速O3的分解:X + O3 = XO + O2;XO + O = X + O2(X=Cl、Br、NO、OH等)。已知:2O3(g)
O+O2。粒子X能加速O3的分解:X + O3 = XO + O2;XO + O = X + O2(X=Cl、Br、NO、OH等)。已知:2O3(g)
 3O2(g)△H=-144.8kJ/mol,t℃时K=3×1076。下列说法不正确的是 ( )
3O2(g)△H=-144.8kJ/mol,t℃时K=3×1076。下列说法不正确的是 ( )
A.臭氧层中氟里昂释放出的氯原子是O3分解的催化剂
B.高压放电条件下O2可以生成O3
C.O3转变为O2能量曲线可用右图表示
D.t℃时,3O2(g)  2O3(g),K≈3.33×10-77
2O3(g),K≈3.33×10-77
12.下列说法中正确的是 ( )
A.等物质的量浓度NaCl和CH3COONa溶液等体积混合:
c(Cl-)> c(Na+)> c(CH3COO-)> c(OH-)> c(H+)
B.25℃时,若10mL盐酸(pH=a)与100mLBa(OH)2溶液(pH=b)混合后恰好中和,则
a + b = 13
C.等物质的量浓度的硫酸与醋酸钠溶液等体积混合:
2c(SO42-) +c(OH-)= c(H+) + c(CH3COOH)
D.向氨水中加水稀释,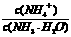 减小
减小
11.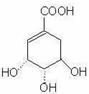 2009年4月始,“H1N1流感”在全球部分地区爆发,引起人们继“非典”之后的世界范围内的恐慌。从烹调香料八角(俗称大料)中提取到的莽草酸是制取抗猪流感药物Tamiflu,(商品名:达菲)的基本原料。莽草酸的结构式如下。下列对莽草酸说法正确的是 ( )
2009年4月始,“H1N1流感”在全球部分地区爆发,引起人们继“非典”之后的世界范围内的恐慌。从烹调香料八角(俗称大料)中提取到的莽草酸是制取抗猪流感药物Tamiflu,(商品名:达菲)的基本原料。莽草酸的结构式如下。下列对莽草酸说法正确的是 ( )
A.分子式:C7H9O5
B.莽草酸可以发生加成、消去、酯化反应
C.莽草酸可以遇到氯化铁溶液变紫色
D.1mol莽草酸与足量钠反应可以产生4mol氢气
10.下列离子方程式书写正确的是 ( )
 A.等浓度等体积的NaHCO3与NaAlO2两溶液混合:H++AlO2-+ H2O
= Al(OH)3↓
A.等浓度等体积的NaHCO3与NaAlO2两溶液混合:H++AlO2-+ H2O
= Al(OH)3↓
B.用两个铜电极电解稀盐酸:2H+ +2Cl- H2 ↑+ Cl2↑
C.次氯酸钠溶液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O
D.当钢铁处于酸性很弱或中性环境中发生吸氧腐蚀,正极反应:
4H+ + O2 + 4e- = 2H2O
9.以下实验或操作不能达到目的的是 ( )
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸
B.苯中混有苯酚,加入适量溴水后分液除去
C.用pH试纸测定CH3COONa溶液的pH,证明CH3COOH是弱电解质
D.将淀粉置于稀硫酸中加热,再滴加银氨溶液,水浴加热,以检验淀粉是否水解
8.已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
|
溶质的质量分数 |
甲溶液密度╱g·cm-3 |
乙溶液密度╱g·cm-3 |
|
1% |
0.95 |
1.02 |
|
5% |
0.92 |
1.04 |
|
9% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是 ( )
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
C.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调节NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是 ( )
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.1mol二价镍全部转化为三价镍时,溶液中通过1mol电子
D.阳极反应方程式为:2Cl--2e-=Cl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com