
题目列表(包括答案和解析)
15.(10分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
 方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
方法一、还原法:在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
有关离子完全沉淀的p H如下表。
|
|
Fe(OH)2 |
Fe(OH)3 |
Cr(OH)3 |
|
Ksp |
8.0×10-16 |
4.0×10-38 |
6.0×10-31 |
|
完全沉淀的pH |
9.0 |
3.2 |
5.6 |
请回答下列问题:
(1)在②中调节pH的范围至 为最好。(填序号)
A.3-4 B.6-8 C.10-11 D.12-14
(2)若在①使FeSO4适当过量、空气适量,使Fe2+与Fe3+的比例恰当时,可产生具有磁性、组成类似于Fe3O4•xH2O的铁氧体悬浮物,变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。
方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:
阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3
和Cr(OH)3沉淀除去。
(3)写出此阴极反应的电极方程式 。现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
14.(8分)氯苯是一种用途广泛的化工原料,是制取农药、医药、染料、助剂及其它有机合成产品的重要中间体,主要用于制造硝基氯苯、苯胺、苯酚、杀虫剂、油漆、快干墨水等,也可以直接作溶剂。它又是与氯碱工业息息相关的重要氯产品。目前国内外生产一氯化苯主要采用苯氯化法 ,即用纯苯和干燥氯气在氯化塔内进行反应,生成的氯化液经过水洗,中和,干燥后,送入粗、精馏塔蒸馏得到成品氯苯。它的生产工艺流程如下:
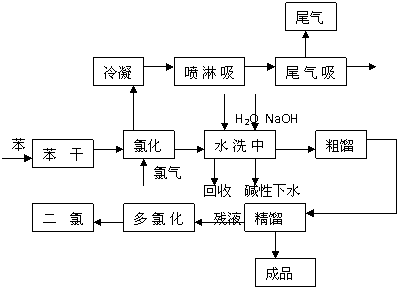

请回答下列问题:
(1)写出由苯与氯气生成氯苯的化学方程式 ;
(2)在上述流程中可以循环利用的物质是 ;
(3)此反应中造成氯苯产率偏低的原因可能有 ;
(4)已知苯的熔点为5.5℃,沸点为80.1℃,不溶于水。下列苯干燥的措施,正确的是
A.在苯中加入浓硫酸,加热 B.在苯中加入氯化钙,蒸馏C.将苯直接蒸馏,收集苯
13.(12分).Ⅰ下列实验操作或对实验事实的描述正确的是 (填序号);
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
②配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦苯与溴水在铁粉的催化作用下制备溴苯
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ.某化学兴趣小组为探究铜跟浓硫酸的反应,用下图装置进行有关实验。请回答下列问题:
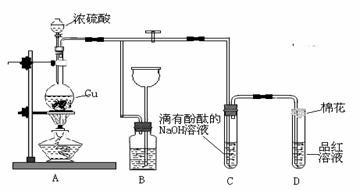
(1)装置A中发生的化学反应的化学方程式为__ _____ _____.
(2)装置B 的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________(填序号)
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3 溶液
(3)装置C和D 中产生的现象相同,但原因却不同。用离子方程式和必要的文字解释C中溶液褪色的原因
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,这种液体是____________。
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色。为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是________(填序号)
① 观察稀H2SO4 溶液呈无色 ②观察CuSO4 粉末呈白色 ③ 稀释CuSO4溶液,溶液蓝色变浅 ④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色
12.下列说法正确的是 ( )
A.常温下,NaHCO3溶液中一定存在c(Na+)+c(H+)=c(HCO3-)+c(OH-)
B.常温下,某溶液中由水电离出的c(H+)=1×10-12mol/L,则该溶液可能是NH4Cl溶液
C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A)
第Ⅱ卷(非选择题 共78分)
11.下列反应的离子方程式书写正确的是 ( )
A.将过量锌粉加入氯化铁溶液中:Zn+2Fe3+=Zn2++2Fe2+
B.将过氧化钠加入水中:2O22-+2H2O=O2↑+4OH-
C.往明矾溶液中中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
D.用澄清石灰水吸收少量的氯气:Cl2+2OH-=Cl-+ClO-+H2O
10.用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是 ( )

A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
9.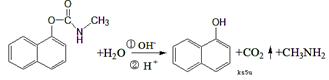 西维因是一种高效低毒杀虫剂,在一定条件下可水解:
西维因是一种高效低毒杀虫剂,在一定条件下可水解:
有关说法正确的是 ( )
A.西维因分子式为C12H10NO2
B.反应后经酸化,可用FeCl3溶液检验是否发生水解
C.1mol西维因最多能与6mol氢气发生加成反应
D.西维因分子中至少有21个原子共平面
8.在一密闭容器中进行如下可逆反应H2(g)+I2(g) 2HI(g),下列有关说法正确的是 ( )
2HI(g),下列有关说法正确的是 ( )
A.不论加多大压强,该化学平衡也不会移动
B.升温,此化学平衡肯定会发生移动
C.其它条件不变,当加入与初始投入量相同量的氢气和碘蒸气,达到平衡后HI的百分含量增大
D.在原平衡基础上,充入氢气,达到新平衡时逆反应速率也会增大
7.下列说法正确的是 ( )
A.用10mL的量筒量取6.4mL氯化钠溶液
B.称取4.0gNaOH固体迅速倒入100mL的容量瓶中,加水至刻度线配制1mol/L的氢氧化钠溶液
C.25mL的滴定管内标准液的准确读数为10.00mL,管内液体全部放出后,溶液体积等于15.00mL
D.工业上常采用电解熔融的氧化镁制取金属镁
6.在下列给定条件的溶液中,可能大量共存的离子组是 (
A.无色溶液:Ca2+、、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH+4、I-、NO3-
C.常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO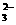
D.含有HCO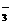 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO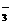 、Ca2+
、Ca2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com