
题目列表(包括答案和解析)
6.某温度下,100 g饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中添加3.5 g氯化钠和6.5 g水,则所得溶液的溶质质量分数是 ( )
A.30% B.26.5+3.5100+6.5×100%
C.26.5% D.26.5+3.5100+6.5+3.5×100%
5.某溶液中大量存在以下五种离子:NO-3、SO2-4、Fe3+、H+、M,其物质的量之比为n(NO-3)∶n(SO2-4)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为 ( )
A.Fe2+ B.Mg2+
C.CO2-3 D.Ba2+
4.设NA为阿伏加德罗常数,下列对于0.3 mol/L硫酸钾溶液的说法不正确的是 ( )
A.1 L溶液中含有0.6 NA个钾离子
B.1 L溶液中含有钾离子和硫酸根离子总数为0.9 NA
C.2 L溶液中钾离子浓度为1.2 mol/L
D.2 L溶液中含有硫酸根离子0.6 NA个
3.(2010年保定模拟)实验室用下列溶质配制一种混合溶液,已知溶液中 则其溶质可能是 ( )
则其溶质可能是 ( )
A.KCl Na2SO4
B.KCl Na2SO4 NaCl
C.NaCl Na2SO4 K2SO4
D.KCl K2SO4 Na2SO4
2.V L Fe2(SO4)3溶液中含Fe3+m g,溶液中SO2-4的物质的量浓度是 ( )

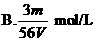
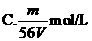
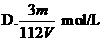
1.下列溶液中的c(Cl-)与50 mL 1 mol/L氯化铝溶液中的c(Cl-)相等的是 ( )
A.150 mL 1 mol/L氯化钠溶液
B.75 mL 2 mol/L氯化铵溶液
C.150 mL 1 mol/L氯化钾溶液
D.75 mL 1 mol/L氯化铝溶液
14. (14分)(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
(14分)(探究创新题)某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
该实验的主要操作步骤如下:
①配制100 mL 1.0 mol·L-1的盐酸溶液;
②用 (填仪器名称并注明规格)量取10.0 mL 1.0 mol·L-1的盐酸溶液加入锥形瓶中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少
为 ;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为V mL
请将上述步骤补充完整并回答下列问题。
(1)用文字表述实验步骤④中检查装置气密性的方法: 。
(2)实验步骤⑤中应选用 (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
读数时除恢复到室温外,还要注意 。
(3)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm= ,若未除去镁条表面的氧化膜,则测量结果 (填“偏大”、“偏小”或“无影响”)。
13.(12分)生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混
合气体。2.016 L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:
 。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产
。当甲烷完全反应后,硬质玻璃管的质量减轻4.8 g。将反应后产
生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀8.5 g。
(1)原混合气体中甲烷的物质的量是 。
(2)原混合气体中氮气的体积分数为 。
12.(12分)在25°C、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体,使其完全燃烧,干燥
后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)= L;V(H2)= L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)= 。
(3)若剩余气体的体积为a L,则a的取值范围是 。
11. (12分)
(1)2 mol O3和3 mol O2的质量之比 ,分子数之比 ,同温同压的密度之比 ,含氧原子
数之比 ,体积之比 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则
相同状况下10 L O3与 L Cl2的消毒能力相当。
(3)气体化合物A的分子式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为 ,推断的依据为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com