
题目列表(包括答案和解析)
22.下图是依各个原子的性质和原子序数(1-20)画的关系图,各图的纵轴可能代表下列的某一性质:质量数、质子数、中子数、最高正价、原子半径相对大小、得电子相对能力。图3中原子序数8、9和图4中原子序数2、10、18在纵轴上没有对应的数值。

(1)图1-图4的纵轴分别代表__________、__________、__________、__________。
(2)已知aA、bB、cC、dD、eE、gG六种元素原子序数依次增大,原子半径按A、E、D、C、B、G的顺序增大,它们分散在三个短周期中。B是生命体的构架元素,E是同周期中半径最小的元素,G的最高价含氧酸的产量是衡量一个国家化工实力的标志。它们的原子序数存在如下关系:①a+b=c,②(b+d)/2=c,③(c+e)/2=d,请根据提供的信息,回答下列问题:
①下图是元素周期表前三周期的边界,请将A-G六种具体元素符号填在表中相应的位置;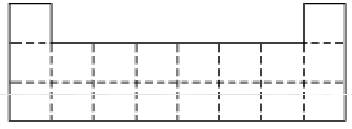
②写出铜与上述某一元素最高价氧化物对应水化物反应的化方程式(任写一个,下同):______________________________________。
③X、Y、Z、W是仅由上述元素组成的四种物质,且有如下转化关系:X+Y―→Z+W。若X为单质,Y、Z、W均为化合物,其相应的化学方程式为__________________________________;若X、Y、Z、W均为化合物,其相应的化学方程式为____________________。
解析:(1)元素的质子数等于该元素的原子序数,故图1纵轴代表质子数。某元素原子的中子数可能等于质子数,也可能大于或小于质子数,故图2纵轴代表中子数。元素的最高正价等于最外层电子数,且O、F无最高正价,故图3纵轴代表最高正价。从图4中,可以发现元素原子的某种性质随原子序数的递增而呈周期性变化(小―→大),故图4纵轴代表得电子能力。
(2)①由题意知,A为H,B为C,C为N,D为O,E为F,G为S。依据元素周期表的结构及元素的结构,把具体的元素符号填入周期表中。②上述元素最高价氧化物对应的水化物可以是浓H2SO4、浓HNO3、稀HNO3。③本问为开放式问题,符合的化学反应方程式特别多。书写时可采用逐族排查无机反应和分类考虑有机反应的方法。
答案:(1)质子数 中子数 最高正价 得电子能力
(2)①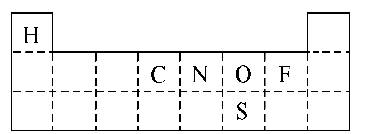
②3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
或Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
或Cu+2H2SO4(浓)△CuSO4+SO2↑+2H2O
③CH4+2O2点燃CO2+2H2O或4NH3+5O2催化剂△4NO+6H2O或2H2S+3O2点燃2SO2+2H2O 3NO2+H2O===2HNO3+NO或SO2+NO2===SO3+NO
21.按下列要求回答:
现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘片六种物质。
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________,物质中只有离子键的物质有________,属于非极性分子的是________。
(3)①的电子式是________________,⑤的电子式是________________。
答案:(1)⑤⑥ ⑤ (2)①③④ ① ⑤⑥
(3)[∶∶]-Ba2+[∶∶]-
∶∶∶C∶∶∶
20.(2009·保定质检)有A、B、C、D、E五种粒子,其组成均有氢元素,且粒子的电子总数均为10个,A是双原子的阴离子,根据下列变化,写出各粒子的化学式及B粒子的空间结构形状。
①A+B△C+D↑ ②C+CA+E ③D+E===B+C
则A__________,B__________,C__________,D__________,E__________,B的空间结构形状是__________,C的电子式是__________________________。
答案:OH- NH H2O NH3 H3O+ 正四面体 H∶∶H
19.X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层总数为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,Z元素是植物生长所需的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素符号:X__________、Y__________、Z__________。
(2)Y元素的单质中有一种称为足球烯的分子Y60,它可能最易发生的反应是__________(填字母)。
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)最近科学家们合成了Z,电子式为
[∶Z⋮⋮Z∶∶Z⋮⋮Z∶]n+,则n值为__________。
(4)Z与X可形成多种化合物,其中ZX3的结构式为__________,Z2X4的电子式为__________。
解析:由X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子层数的2倍,可知X是H,Y可能是C或S,Z元素是植物生长的重要营养元素,Z可能是N、S、P中之一。结合其他条件判断Y、Z分别是C、N。问题的回答则依据信息即可。
答案:(1)H C N (2)C (3)1
(4)
18.(2009·厦门质检)元素R的原子中,最外层上的电
子数比次外层上的电子数多2个,则R不能形成的化合物是( )
A.RO B.R2H4
C.HRO2 D.H2R2O4
解析:元素R只能是C元素。
答案:C
第Ⅱ卷(非选择题,共46分)
17.A元素原子的L层比B元素原子的L层少3个电子,B元素原子核外电子数比A元素原子核外电子总数多5个,则A、B两元素形成的化合物可表示为( )
A.BA2 B.BA3
C.A3B2 D.B3A2
解析:核外电子总数B比A多5个,则A原子L层肯定没排满,如B的L层已排满,则A的L层只有5个电子,A为N元素,B共有2+5+5=12个电子,应为Mg元素,N和Mg可以形成Mg3N2。
答案:D
16.在离子RO中共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A.A-x+n+48 B.A-x-n-24
C.A-x+n+24 D.A+x-n-24
解析:R原子所含电子数为x-n-24,则中子数为A-(x-n-24)=A-x+n+24,故选C。
答案:C
15.Na+、F-、Ne可以归为一类,与它们同类的粒子组是( )
A.H2O、OH- B.K+、H3O+
C.NH、NH3·H2O D.OH-、H2O2
答案:A
14.“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有( )
A.4种 B.5种 C.6种 D.7种
解析:属于主族的元素有K、O、Si、Mg、Al、Ca、Na七种。
答案:D
13.下列各图曲线分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是( )

A.图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B.图②可以表示ⅡA族元素的最外层电子数
C.图③可以表示ⅥA族元素氢化物的沸点高低关系
D.图④可以表示第三周期中的非金属元素对应单质的熔点高低关系
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com