
题目列表(包括答案和解析)
1.(2009·唐山模拟)下列表达方式正确的是 ( )

答案:C
20.(2009·福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
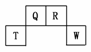
(1)T的原子结构示意图为__________________________________________________。
(2)元素的非金属性(原子的得电子能力)为:Q________(填“强于”或“弱于”)W。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为____________________________________________。
(4)原子序数比R多1的元素的一种氢化物,能分解为它的另一种氢化物,此分解反应的化学方程式是
________________________________________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___________________________________________________。
(6)在298 K下,Q、T的单质各1 mol完全燃烧,分别放出热量a kJ和b kJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3 mol Q的单质,则该反应在298 K下的ΔH=________(注:题中所设单质均为最稳定单质)
解析:由信息可知,T为第3周期ⅢA族元素,即为Al: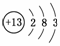 ,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
,Q,R,W分别为C、N、S,则(1)、(2)、(3)、(4)易解答;(5)中N的氧化物中相对分子质量最小的为NO,(6)C(s)+O2(g)===CO2(g);ΔH=-a kJ/mol,……①
Al(s)+O2(g)===Al2O3(s);ΔH=-b kJ/mol,……②
则反应4Al(s)+3CO2(g)===3C(s)+2Al2O3(s)为ΔH=②×4-①×3=(3a-4b)kJ/mol。
答案:(1)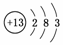 (2)弱于
(2)弱于
(3)S+2H2SO4(浓)3SO2↑+2H2O
(4)2H2O22H2O+O2↑
(5)NaNO2
(6)(3a-4b) kJ·mol-1
19.(2009·天津)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
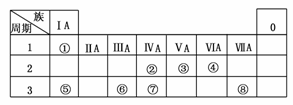
(1)④⑤⑥的原子半径由大到小的顺序是____________________________________。
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是
________________________________________________________________________。
(3)①④⑤⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
________________________________________________________________________。
(4)由表中两种元素的原子按1?1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为________________________________________,
N→⑥的单质的化学方程式为_______________________________________________,
常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
________________________________________________________________________。
解析:据元素的位置可知,①-⑧元素依次为H、C、N、O、Na、Al、Si、Cl,再对号入座,其中(5)由框图可确定N为Al2O3,Z为Al(OH)3。M应为NH4Cl,则X、Y为AlCl3、NH3·H2O,为使NH4Cl中由NH4Cl电离出的c(NH)=c(Cl-)可加入NH3·H2O(Y)至溶液pH等于7。
答案:(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3
(3)Na+[∶····‖H]-(或Na+[∶····∶····∶]-)
(4)a、b (5)Al3++3NH3·H2O===Al(OH)3↓+3NH
2Al2O3(熔融)电解冰晶石4Al+3O2↑ 溶液的pH等于7
18.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如下所示的转化关系。
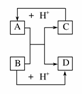
(1)如果A、B、C、D均是10电子的微粒,请写出:A的结构式________;D的电子式________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式_______________________________________。
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________>________。
(3)已知肼(H2N-NH2)和甲胺(CH3-NH2)都是18个电子的分子。分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式(至少写两个):________。
解析:(1)观察框图,容易想到NH+OH-NH3+H2O或HF+OH-===F-+H2O反应。
(2)①18电子微粒很多,酸碱中和是容易想到的:H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O。②联想强酸制弱酸的道理,可得到强碱制弱碱,结合质子的能力显然B>C。
(3)按C、H、O、F替换即可。
答案:(1) 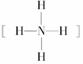 或H-F H∶····∶H
或H-F H∶····∶H
(2)①H2S+OH-===HS-+H2O或HS-+OH-===S2-+H2O ②OH- S2-(或HS-)
(3)CH3-CH3,CH3-OH,CH3-F
17.(2009·江苏)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
解析:据“X的原子半径最小”可知X为H元素;据“Y原子最外层电子数是次外层电子数的3倍”可知Y原子结构示意图为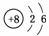 ,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
,即Y为O元素,R与Y同一主族且属短周期元素,所以R是S元素;Z、W两元素与R同周期,且Z、W原子的核外电子数之和等于8+16=24,所以Z只能为11号元素Na,W只能为13号元素Al。A项中O2-、Na+、Al3+的离子半径依次减小;B项中H元素与O元素可以形成化合物H2O2;C项中氢化物的热稳定性H2O>H2S;D项中W对应的Al(OH)3为两性氢氧化物。
答案:C
16.(2009·北京)W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7?17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是 ( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
解析:W为氯元素(Cl),X为氟元素(F),Y为铝元素(Al),Z为钠元素(Na),则B项:因HF分子间有氢键,沸点HF>HCl,D项:原子半径符合,而离子半径应为F->Na+>Al3+。
答案:B
15.(2009·山东)元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的是 ( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
解析:A项如碘元素可形成FeI2(非金属性)、I(NO3)3(金属性),C项如Li+、Be2+为2电子。
答案:B
14.(江苏省扬州中学2008-2009学年度第二学期月考)原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是 ( )
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为KXO3的含氧酸钾盐
C.X原子最外层电子数和核电荷数肯定为奇数
D.X能与某些金属元素形成化合物
解析:若n=1,则最外层电子数为3,不存在;若n=2,则最外层电子数为5,质子数为7,符合2n2-1的即为氮元素;若n=3,最外层电子数为7,质子数为17,符合2n2-1的即为氯元素。所以X为氮元素或者氯元素,A项错误;X能形成KNO3或者KClO3,B项正确;从上述分析可知,C项正确;N、Cl都能与金属单质反应,如3Mg+N2===Mg3N2、Mg+Cl2===MgCl2,D项正确。
答案:A
13.(2008·广东梅州3月)下列各组物质的性质比较,正确的是 ( )
A.酸性:HClO4>H3PO4>H2SO4
B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.氧化性:F2>Cl2>Br2>I2
解析:A项应为HClO4>H2SO4>H3PO4;B项应为HF>H2O>H2S;C项应为NaOH>Ca(OH)2>Mg(OH)2。
答案:D
12.(2009·皖南八校高三第一次联考)Y元素的最高正价与最低负价的绝对值之差是4;Y元素可与M元素形成离子化合物,并在水中电离出电子层结构相同的阴、阳离子,则该化合物是 ( )
A.K2S B.Na2S
C.Na2O D.KCl
解析:S元素的最高正价是+6,最低负价是-2,绝对值之差是4,与S2-电子层结构相同的是K+。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com